RAYONS X
Les premiers instruments sont nés de la
découverte des rayons X
par
Wilhelm Röntgen, physicien allemand,
en 1896. Les rayons X traversent le corps humain en étant plus ou moins absorbés selon la densité des tissus pénétrés : les os sont plus opaques que les muscles, comme le montre la première radiographie que le physicien fit de la main de sa femme. Très vite apparaît l’intérêt d’une telle découverte pour la médecine : explorer le corps humain sans l’ouvrir !
Antoine Béclère, médecin français, acquiert l’année suivante, pour l’hôpital Tenon à Paris, un radioscope et effectue les premiers dépistages de la tuberculose par radioscopie des poumons.
Au cours de la Première guerre mondiale, les voitures radiologiques équipées par Marie Curie sillonnent les champs de bataille pour aider les chirurgiens à repérer les éclats d’obus chez les soldats blessés avant d’opérer. Cette technique est encore exploitée pour déceler des fractures ou des tissus endommagés par une maladie (pulmonaire par exemple) de manière simple : une source émettrice de rayons X et un détecteur sont placés de part et d’autre de la portion du corps à radiographier, et en fournissent une "photographie", une projection sur le plan du détecteur de l’atténuation des rayons X par les tissus traversés.
Cliquez sur les images pour les agrandir.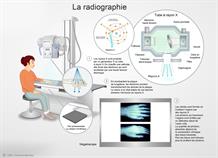
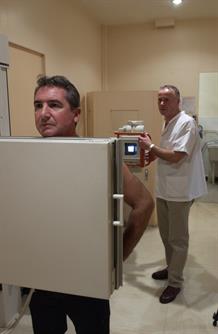
Examen de radiographie pulmonaire. © F. Vigouroux/CEA
Le scanner repose sur le même principe ; la rotation simultanée de la source et du détecteur permet d’obtenir plusieurs projections à partir desquelles sont reconstruites des images 3D.
QUELQUES DATES
-
1896 Découverte des rayons X par W. Röntgen, physicien allemand. Prix Nobel de physique en 1901.
-
1897 Installation du premier service de radiologie par A. Béclère, à l’hôpital Tenon.
-
1950 Apparition du premier scanner manuel, doté d’un
compteur Geiger-Müller puis d’un compteur à scintillations.
-
1963 G.N. Hounsfield, ingénieur britannique, met au point des algorithmes mathématiques qui seront utilisés pour les scanners.
-
1972 Conception du premier scanner X suite aux recherches d’A.M.L. Cormack, physicien sud-africain, et de G.N. Hounsfield. Prix Nobel de médecine en 1979
IMAGERIE NUCLÉAIRE D’ÉMISSION
En 1934, la découverte de la radioactivité artificielle par Frédéric et Irène Joliot-Curie, physiciens et chimistes français, ouvre la voie au développement des radioéléments de courte durée de vie. Associée à l’utilisation de traceur pour cibler des phénomènes biologiques, initiée par le chimiste hongrois George de Hevesy, elle pose le principe de l’imagerie fonctionnelle et moléculaire.
Les radiopharmaceutiques
DEFINITION
Positon : particule de même masse et de charge opposée à celles de l’électron, aussi appelé positron.
A SAVOIR
"LA DÉCROISSANCE RADIOACTIVE" A cause d’un excès de protons, neutrons (ou des deux), certains noyaux sont instables : ils sont radioactifs. Ils se transforment spontanément en d’autres noyaux, en émettant des particules ; on dit qu’ils se désintègrent, jusqu’à atteindre un état stable. La désintégration radioactive d’un noyau est un phénomène aléatoire. Au bout d’un temps T, appelé "période" ou "demi-vie", l’activité d’un échantillon a été divisée par 2. Au bout de 2 périodes, il reste un quart des noyaux radioactifs, au bout de 3 périodes, un huitième… après 10 périodes, il n’en reste qu’un millième. Cette période est connue pour tous les noyaux radioactifs, elle varie de quelques nanosecondes, plusieurs jours… à des centaines, voire des milliards d’années.

UNE DATE
1957H.O. Anger, ingénieur et biophysicien américain, invente la première gamma-caméra de scintigraphie, produisant des images du fonctionnement des organes.


DEFINITIONS
LE SPIN NUCLÉAIRE est une caractéristique qui contribue au moment magnétique. LE TESLA (T) est l'unité de champ magnétique. Le champ magnétique terrestre a une intensité d’environ 50 millionièmes de tesla.


DEFINITIONS
SUBLIMINAL : enregistré par le cerveau sans que l’on en ait conscience, de l’ordre du subconscient. NEUROTRANSMETTEUR : molécule permettant la transmission d’une information, d’une cellule nerveuse à une autre.
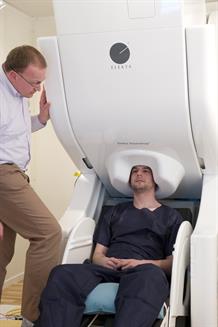
Développement d’une nouvelle génération de MEG basée sur des capteurs magnétiques innovants. © P. Stroppa/CEA
On appelle radiopharmaceutique la molécule résultant de l’association d’un traceur et d’un atome radioactif, injectable à l’homme ; la molécule est dite "marquée". Ce marquage permet de repérer le devenir du traceur après son incorporation dans le corps et ainsi d’étudier la physiologie des organes sans opération. Les isotopes radioactifs utilisés en imagerie sont des émetteurs gamma (par exemple l’iode 123 ou le technétium 99m) ou des émetteurs de positons (par exemple le fluor 18 ou le carbone 11).
Les radioéléments utilisés pour le diagnostic médical sont choisis selon plusieurs critères : délivrer une dose d’irradiation la plus faible possible, posséder une durée de vie radioactive courte et émettre un rayonnement décelable à l’extérieur du corps.
Ils sont produits par un
accélérateur de particules, nécessairement à proximité du site d’imagerie pour les isotopes de très brève demi-vie comme le carbone 11 (période d'un peu plus de 20 minutes). Puis, ils sont incorporés aux molécules dans des enceintes blindées, contrôlés (pureté chimique, pureté isotopique) avant d’être injectés au patient, par voie respiratoire ou intraveineuse.
Le type de marquage radioactif, par des émetteurs gamma ou des émetteurs de positons, donne naissance à deux familles d’imagerie différentes, la scintigraphie et la tomographie monophotonique d’une part et la tomographie par émission de positons d’autre part. Celles-ci seront utilisées en fonction des indications médicales.

Mise en place de réactifs lors de la préparation d’un radiopharmaceutique. © P-F. Grosjean/CEA
La scintigraphie et la tomographie par émission de simple photon (TEMP)
Les isotopes utilisés pour ces examens émettent de simples photons (par exemple le xénon 133 ou l’iode 123). Comme ce sont des isotopes de numéro atomique élevé, ils peuvent modifier les propriétés de la molécule dans laquelle ils sont incorporés. Leur période est plus longue comparée à celle des émetteurs de positons.
Comment ça marche ?
Pour réaliser une scintigraphie monophotonique (SPECT de l’anglais : Single photon emission computed tomography), une petite quantité de traceur radioactif est injectée au patient. Ce traceur se distribue dans l'ensemble du corps grâce à la circulation sanguine, puis s'accumule progressivement dans les organes qui le métabolisent. Il se fixe spécifiquement sur l'organe que l'on cherche à analyser. La désintégration des radio-isotopes produit des rayonnements dans toutes les directions, les photons émis sont récoltés par une gamma-caméra qui peut tourner autour du patient. Lorsque l'appareil réalise plusieurs enregistrements de la même zone avec différentes positions du détecteur, un traitement informatique permet de reconstruire des images 3D de l’organe.
Pour ces examens, les atomes radioactifs utilisés ont une demi-vie relativement courte (6 h pour le technétium 99m, l’isotope le plus utilisé, 13 h pour l’iode 123) et leur radioactivité a disparu au bout de quelques jours (10 demi-vies). Cette technique est utilisée pour l’exploration de la thyroïde, du squelette ou pour évaluer le fonctionnement du coeur.

Examen de scintigraphie. © L. Médard/CEA
La tomographie par émission de positons
Une des grandes applications de la TEP est la cancérologie, pour le bilan d’extension des tumeurs, le suivi thérapeutique et le bilan des récidives. D’autres pathologies sont aussi étudiées comme les maladies neurologiques et neurodégénératives, cardiovasculaires ou psychiatriques. Ces dernières applications relèvent du domaine de la recherche.
Comment ça marche ?
Les examens de tomographie par émission de positons (TEP) utilisent principalement le fluor 18 et le carbone 11. Les positons émis se combinent avec des électrons environnants et s’annihilent en émettant deux photons dans des directions diamétralement opposées. Une couronne de détecteurs, situés de part et d'autre de la région cible, captent ces photons. Après traitement informatique, les paires de photons détectées, pendant un intervalle de temps donné, permettent de reconstruire les images de la zone explorée, par "tranches" de quelques millimètres d'épaisseur.
QUELQUES DATES
-
1896 : H. Becquerel, physicien français, découvre que l’uranium émet des rayonnements invisibles, différents des rayons X. P. et M. Curie nomment ce phénomène "radioactivité naturelle". Prix Nobel de physique en 1903.
-
1928 : H. Geiger et W. Müller, physiciens allemands, créent le premier compteur de particules chargées.
-
1930 : E.O. Lawrence, physicien américain, met au point un accélérateur de particules électromagnétique de haute fréquence, précurseur des cyclotrons.
-
1934 : I. et F. Joliot, physiciens français, découvrent la radioactivité artificielle. Ils estiment que les radioéléments pourront être utilisés comme traceurs de nombreuses fonctions de l’organisme. Prix Nobel de physique en 1935.
-
1935 : G.C. de Hevesy étudie la circulation sanguine et la formation des os grâce à une solution de phosphate de sodium radioactif ; le principe de l’imagerie fonctionnelle et moléculaire est posé. Prix Nobel de chimie en 1943.
-
1965 : Mise au point des premiers tomographes par émission de positons au laboratoire de recherche en physique du Massachusetts General Hospital, avant leur utilisation plus étendue en milieux hospitaliers dans les années 1990.
IMAGERIE PAR RÉSONANCE MAGNÉTIQUE
L’imagerie par résonance magnétique (IRM) exploite le phénomène de résonance magnétique nucléaire, découvert en 1938 par Isaac Isidor Rabi, physicien américain, puis mesuré en 1946, indépendamment par Félix Bloch, physicien suisse, et Edward Mills Purcell, physicien américain.
L’IRM repose principalement sur les propriétés magnétiques des atomes d’hydrogène, très abondants dans le corps humain en grande partie sous forme d'eau, et dont le noyau possède un spin nucléaire. Lorsque le patient est placé dans un champ magnétique puissant (de 1,5 ou 3 teslas aujourd’hui), les spins des noyaux d’hydrogène s’alignent sur le champ magnétique. L’envoi d’impulsions radiofréquence d’énergie proportionnelle au champ magnétique perturbe cet alignement. Le retour à l'état initial ou relaxation s’accompagne de l’émission d’une onde électromagnétique caractéristique, détectée par l'antenne et dont l’analyse fournit des images 3D des organes explorés. Avec cette technique d’imagerie, les chercheurs peuvent étudier finement les tissus "mous" : cerveau, moelle épinière, muscles… en connaître la structure, détecter des tumeurs cancéreuses - c’est l’IRM anatomique.
L’IRM ne permet pas seulement d’étudier la morphologie des organes, elle permet de suivre le fonctionnement du cerveau (l’IRM fonctionnelle) et de connaître l’organisation tissulaire (c'est l
'IRM de diffusion). Au niveau du cerveau, la tractographie, réalisée à partir de séquences d'IRM de diffusion, permet de visualiser les fibres neuronales.
L’IRM fonctionnelle cérébrale, IRMf
Quand nous parlons, lisons, pensons… certaines aires de notre cerveau s’activent. Pour cela, les neurones ont besoin d’énergie, en particulier du glucose circulant dans le sang, et de l'oxygène apporté par l’hémoglobine. En conséquence, le flux sanguin augmente dans cette région. L’hémoglobine déchargée de son oxygène perturbe localement le champ magnétique ; cette modulation du signal est mesurée en IRM fonctionnelle. Il s’agit donc d’une mesure indirecte du fonctionnement des neurones.
En augmentant le champ magnétique des aimants des scanners IRM (passant de 1,5 à 3 et bientôt 11,7 T), les images gagnent en précision et les chercheurs peuvent ainsi étudier le fonctionnement du cerveau à l’échelle de quelques milliers de neurones (et non plus de millions).
L’IRM de diffusion, IRMd
C’est une autre modalité d’imagerie offerte par l’IRM. Elle apporte des informations que ni l’IRMf ni l’IRM anatomique ne fournissent. Cette technique s’appuie sur l’observation de la mobilité des molécules d’eau à l'intérieur des cellules. Les membranes des cellules confinent ces molécules, qui s'y déplacent de façon aléatoire. Pour les cellules nerveuses, les axones qui prolongent les corps cellulaires sont des fibres longues. Le déplacement des molécules d'eau, pendant un intervalle de temps donné, a une forme allongée dans l'axe de ces fibres neuronales. L’analyse IRM permet de visualiser ces parcours et de reconstituer le réseau des fibres nerveuses à l’intérieur du cerveau, qui est aussi appelé les "routes de l’information", c'est la tractographie.
Basée sur le même principe que l’IRM, la spectroscopie par résonance magnétique permet la quantification précise d’autres molécules que l'eau dans l’organisme.
MAGNÉTO-ENCÉPHALOGRAPHIE ET ÉLECTRO-ENCÉPHALOGRAPHIE
Comment ça marche ?
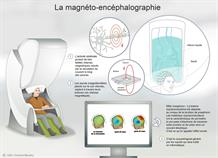
La magnéto-encéphalographie (MEG) est basée sur la captation et l’enregistrement de l’activité magnétique des neurones résultant de l’activité du cerveau. La conduction de l’influx nerveux par les neurones équivaut à un courant électrique le long d’un "fil" constitué par les axones, qui induit un champ magnétique perpendiculaire au sens de circulation du courant. Pas moins de 300 capteurs répartis sur un casque placé sur la tête du patient enregistrent en continu ce très faible signal, de l’ordre du femtotesla (10-15 T).
Par reconstruction inverse, l’activité cérébrale est repérée dans l’espace (à quelques millimètres près) et le temps (à l'échelle de la milliseconde), permettant aux chercheurs de comprendre la dynamique du traitement de l’information. La MEG a été exploitée avec succès pour percer le mystère des phénomènes subliminaux et l'accès des informations à la conscience.
Le passage de l’influx nerveux d’un neurone à l’autre est possible grâce à la libération de neurotransmetteurs. Ces molécules chimiques créent une différence de charge, et donc une légère tension électrique locale au niveau des synapses, ces espaces entre les neurones. Ces micro-tensions sont mesurées par des électrodes positionnées sur le cuir chevelu du patient. Ainsi,
l’électro-encéphalographie (EEG) permet de visualiser et de localiser rapidement une activité cérébrale.
QUELQUES DATES
-
1946 : E.M. Purcell, physicien américain, et F. Bloch, physicien suisse, découvrent la résonance magnétique nucléaire, base de la spectroscopie RMN. Prix Nobel de physique en 1952.
-
1970 : Développement des premiers magnéto-encéphalographes.
-
1973 : Apparition des premiers appareils d’imagerie par résonance magnétique, suite aux travaux simultanés de P. Lauterbur, chimiste américain, et P. Mansfield, physicien britannique.
Prix Nobel de médecine en 2003.
ULTRASONS
Comment ça marche ?
Cette technique d’imagerie exploite la transmission d’ondes ultrasonores par les tissus. Elle est composée d’une sonde émettant des ondes vers les tissus et réceptionnant celles qu’ils renvoient. Selon leur densité, les tissus traversés font écho différemment : plus le tissu est dense, plus l’écho est important. Les ondes reçues sont analysées pour fournir une image. Ainsi, sur une
échographie de suivi de grossesse, il est possible de différencier le squelette et les organes du foetus baignant dans le liquide amniotique.
LES PLATEFORMES DE RECHERCHE EN IMAGERIE MÉDICALE
Le CEA dispose de cinq plateformes d’imagerie dotées d’équipements de haute technologie, dédiées à la recherche dans le domaine des maladies neurodégénératives, des maladies infectieuses et des cancers. Elles sont ouvertes à la communauté scientifique, aux universitaires ainsi qu’aux industriels.
Trois sont implantées en Île-de-France :
- NeuroSpin est un centre de recherche en neuro-imagerie par résonance magnétique en champ intense (supérieur ou égal à 3 T). Ses appareils d’IRM permettent d’observer le cerveau, son fonctionnement et ses pathologies avec une précision encore plus fine que sur les systèmes “conventionnels”, à une échelle plus représentative des phénomènes qui l’animent.
- Le Service Hospitalier Frédéric Joliot (SHFJ) est une unité de diagnostic et de recherche implantée au coeur de l’hôpital d’Orsay. Au SHFJ, des explorations fonctionnelles non-traumatiques de divers organes permettent d’étudier leur fonctionnement et leur métabolisme, dans des conditions normales et pathologiques ou sous l’effet de médicaments, pour le diagnostic et la recherche clinique en oncologie (cancérologie) et neurologie principalement.
- MIRCen est un centre de recherche préclinique cogéré par le CEA et l'Inserm, dédié à la mise au point de nouvelles stratégies thérapeutiques pour les maladies neurodégénératives.
À Caen, le centre Cycéron se consacre à l’imagerie moléculaire pour les recherches biomédicales, principalement dans le domaine des neurosciences et de l’oncologie.
Clinatec, implanté à Grenoble, associe sur un même site une plateforme technique développant des dispositifs technologiques de pointe et un hôpital doté des meilleurs équipements, dans l’objectif d’accélérer le transfert des innovations jusqu’au patient. L’imagerie est utilisée au cours des interventions chirurgicales pour guider le geste du chirurgien.