Qu’est-ce que la radioactivité ?
Dans la nature, la plupart des noyaux d’atomes sont stables, c’est-à-dire qu’ils restent indéfiniment identiques à eux-mêmes. Les autres sont instables car ils possèdent trop de protons ou de neutrons ou trop des deux. Pour revenir vers un état stable, ils sont obligés de se transformer.
Ils expulsent alors de l’énergie – provenant de la modification du noyau – sous forme de rayonnements : c’est le phénomène de radioactivité.
Les atomes qui possèdent cette propriété de transformation spontanée en d’autres éléments en émettant de l’énergie sous forme de rayonnements sont appelés «
radionucléides » ou «
radio-isotopes » (isotope radioactif).
Les atomes
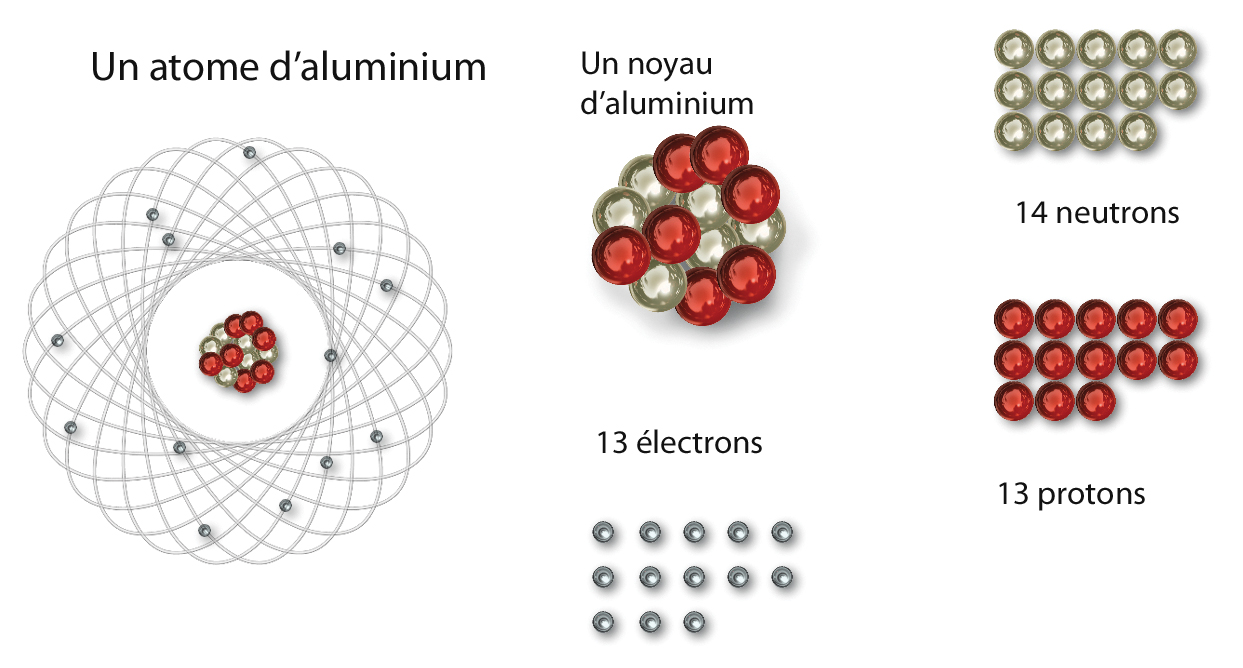
Représentation d'un atome d'aluminium. © Yuvanoe/CEA
Les atomes sont les constituants de base de toute la matière. Ils sont tous bâtis sur le même modèle :
un noyau, formé de particules lourdes – protons et neutrons – autour duquel se déplacent les électrons, particule près de 2000 fois plus légère qu’un proton ou neutron. Dans un atome, le nombre de protons est égal au nombre d’électrons. Ce nombre Z, appelé numéro atomique, définit les propriétés chimiques de l’atome et c’est le chimiste russe Dimitri Mendeleïev qui eut l’idée de ranger les éléments chimiques dans un tableau de classification publié en 1869. Z = 1 représente l’hydrogène, Z=8 l’oxygène, Z=92 l’uranium, etc. On connaît aujourd’hui 118 éléments chimiques.
Les isotopes

Représentation des isotopes de l'hydrogène.
© Yuvanoe/CEA
Un élément chimique est formé d’atomes ayant le même nombre de protons Z. Ils ont donc tous le même nombre d’électrons et les mêmes propriétés chimiques.
Mais ils peuvent différer par leur nombre N de neutrons : ce sont les isotopes de l’élément en question.
Chaque isotope d’un élément est caractérisé par son nombre de protons et neutrons dans son noyau. Ce nombre de masse est toujours noté en exposant à gauche du symbole chimique de l’élément : les isotopes du carbone, par exemple, possèdent tous 6 protons et le plus souvent, 6, 7 ou 8 neutrons. On parle alors du carbone 12 (12C), du carbone 13 (13C) ou du carbone 14 (14C). Parmi ces 3 isotopes du carbone, seul le 14C est radioactif, les 2 autres sont stables. On connaît aujourd’hui près de 2 800 isotopes dont 2 500 environ sont radioactifs.
Les différentes formes
de radioactivité
Près de 2 500 atomes, dont la plupart ont été fabriqués par l’homme, sont radioactifs.
On distingue trois formes de radioactivité, correspondant aux trois types de rayonnements émis lors des transformations des noyaux instables.
-
Le rayonnement « alpha » [α] est constitué de particules composées de deux protons et de deux neutrons (noyau d’hélium). Il concerne les noyaux lourds : l’uranium 238, par exemple, se transforme en thorium 234. Ce rayonnement, qui perd très vite son énergie, a un pouvoir de pénétration très faible. Il ne parcourt que quelques centimètres dans l’air. Une feuille de papier ou les couches superficielles de la peau l’arrêtent.
-
Le rayonnement « bêta » [β] provient de la transformation dans le noyau soit d’un neutron en proton (il y a alors émission d’un électron β-) soit d’un proton en neutron (il y a émission d’un positon, « électron » de charge positive β+ ). Ce rayonnement ne parcourt que quelques mètres dans l’air. Il est stoppé par une vitre ou une feuille d’aluminium.
-
Le rayonnement « gamma » [γ] est un rayonnement électromagnétique, comme la lumière visible ou les rayons X, mais plus énergétique. Il est émis le plus souvent par des noyaux possédant encore un excès d’énergie à évacuer après une désintégration α ou β. Son parcours dans l’air est de plusieurs centaines de mètres et de fortes épaisseurs de plomb ou de béton sont nécessaires pour l’atténuer.
Les rayonnements radioactifs, comme tous les rayonnements, transportent de l’énergie et interagissent avec la matière, notamment le vivant. Certains rayonnements (alpha, bêta, gamma et X) sont dit « ionisants » parce qu’ils transportent une grande quantité d’énergie qui provoque un changement de la charge électrique des atomes qu’ils traversent (phénomène d’ionisation). Ils peuvent être, dans certaines conditions d’exposition, dangereux pour les êtres vivants et il faut savoir s’en protéger.
La radioactivité diminue
dans le temps
Chaque radionucléide est caractérisé par sa
période radioactive,
temps au bout duquel la moitié des atomes radioactifs, initialement présents, a disparu par transformation spontanée. Celle-ci peut varier de quelques secondes à quelques heures voire quelques centaines ou milliards d’années.
Par exemple :
- la période radioactive de l’uranium-238 est de 4,5 milliards d’années ;
- la période radioactive de l’uranium-235 est de 710 millions d’années ;
- la période radioactive du césium-137 est de 30 ans ;
- la période radioactive des atomes d’iode-131 est de 8 jours ;
- la période radioactive des atomes de fluor-18 est de 110 minutes.
La radioactivité
au cœur de nombreux enjeux
et applications
Les recherches sur la radioactivité ont contribué à la connaissance de la matière, permis de reconstituer l’histoire de l’Univers et de la Terre et procuré des marqueurs, outils et instruments irremplaçables en biologie, médecine et géologie.
Les propriétés de la radioactivité et les nombreuses applications qui en ont découlé sont de plus en plus présentes dans notre vie quotidienne :
l’énergie nucléaire est une énergie extrêmement concentrée, et sa transformation aboutit notamment à la production d’électricité ;
les radioéléments naturels sont d’excellents chronomètres : la décroissance radioactive et la mesure de l’activité fournissent ainsi des « horloges » destinées à dater des événements plus ou moins anciens ;
l’extrême sensibilité de la mesure des rayonnements offre la possibilité de suivre à la trace des marqueurs, et de dévoiler aussi bien les mécanismes du corps humain que ceux du système solaire et de la Terre ;
les propriétés des rayonnements sont également précieuses pour aider au diagnostic, grâce aux techniques d’imagerie, et traiter certaines maladies, comme le cancer.
L’évolution des connaissances et des applications depuis plus de cent ans est loin d’être achevée. En recherche fondamentale, la physique nucléaire notamment n’a pas fini de livrer tous ses secrets.