De nombreuses protéines, tant chez les eucaryotes -dont l’Homme- que chez les virus, ne possèdent pas de structure tridimensionnelle fixe. Ces molécules "intrinsèquement désordonnées" changent de conformation en permanence. Les méthodes classiques de la biologie structurale peinent à les décrire, et encore plus à rendre compte de leurs interactions avec d’autres molécules.
En associant de multiples mesures par spectroscopie RMN, une équipe de l’IBS (CEA-CNRS-Université Grenoble-Alpes) a mis au point une nouvelle technique d’approche. Elle l’a appliquée, chez le virus Sendaï (un "cousin" du virus de la rougeole) à la manière dont une nucléoprotéine (NT), très flexible, adopte une conformation intermédiaire avant de reconnaître une phosphoprotéine (PX), former avec elle un complexe dynamique et finalement se fixer à un site d’interaction spécifique. Les chercheurs ont pu reconstituer le film des évènements, en relief et à l’échelle atomique.
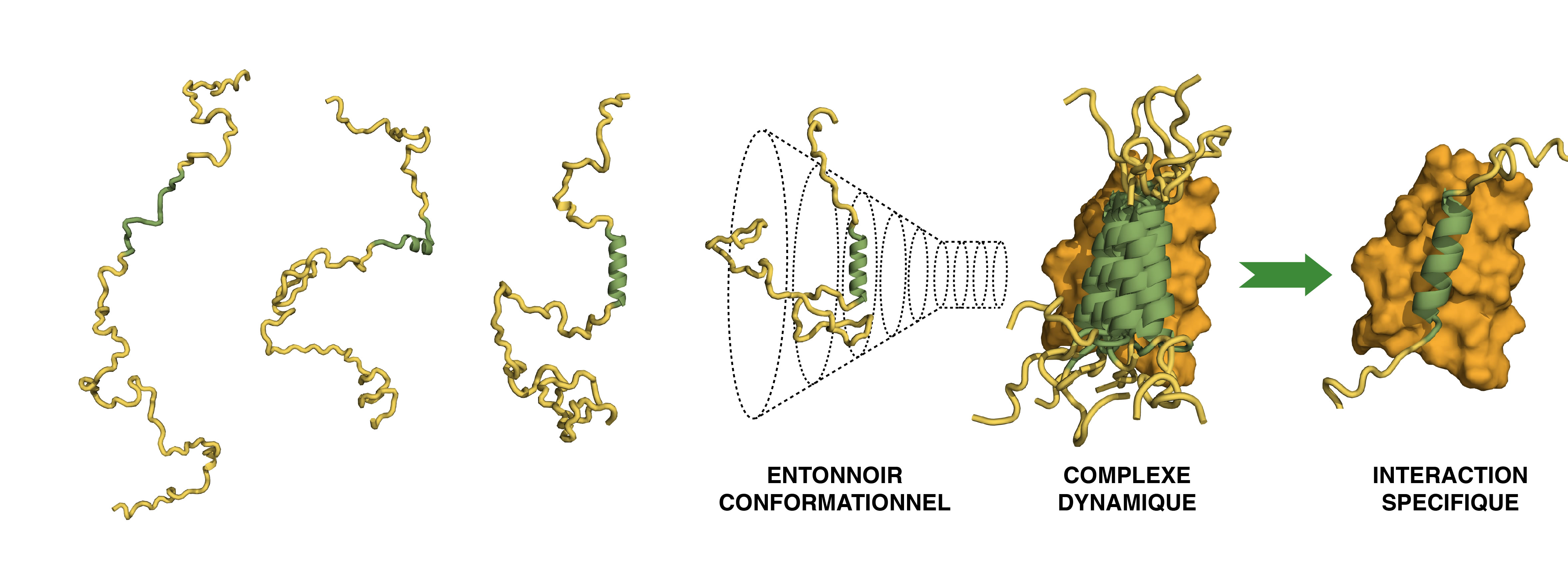
A l'état libre, NT change très rapidement de conformation. Une de ces conformations est privilégiée pour la rencontre avec PX. NT reste d'abord dynamique à la surface de PX avant de se fixer au site d'interaction spécifique.
Outre l’exploit technique, ces résultats sont d’autant plus importants que la liaison entre NT et PX est indispensable à la réplication du virus et donc à l’infection de l’hôte. De manière générale, les protéines désordonnées interviennent dans des mécanismes biologiques essentiels comme la signalisation cellulaire, la transcription ou la réplication de l’ADN, ainsi que dans de nombreux processus pathologiques. D’où l’intérêt de cette méthode pour mieux comprendre leur fonction et éventuellement développer de nouvelles molécules pharmacologiques.