Le transport de grosses molécules (protéines, ARN...) du cytoplasme vers le noyau, et inversement, est essentiel au fonctionnement de la cellule. Le mécanisme de ce phénomène, très difficile à visualiser, restait cependant controversé, en particulier en ce qui concerne la vitesse et la spécificité du transport. Une collaboration internationale entre l'IBS (CEA-CNRS, Grenoble), l'EMBL (Heidelberg), le HITS (Heidelberg) et l'université de Cambridge (Grande-Bretagne) vient de lever le voile en l'examinant au niveau moléculaire. La membrane nucléaire comporte des pores encombrés d'un enchevêtrement de nucléoporines, ou Nups, des protéines intrinsèquement désordonnées1 riches en motifs phénylalanine-glycine2. Cette barrière d'une trentaine de nanomètres d'épaisseur ne laisse passer que des protéines particulières, appelées transporteurs, qui assurent la navette entre l'intérieur et l'extérieur du noyau en emportant leur "cargaison". La seule façon pour une grosse molécule3 de franchir le pore est d'être prise en charge par un de ces transporteurs nucléaires.
Ce mécanisme suppose à la fois la reconnaissance spécifique du transporteur par les Nups et une extrême rapidité de leurs interactions, puisque la traversée ne demande que quelques millisecondes. Or la sélectivité des interactions protéiques implique en général une dynamique lente. Pour comprendre comment le pore nucléaire résout cette contradiction, l'équipe internationale a dû combiner plusieurs techniques: la fluorescence à molécule unique, la RMN, la simulation dynamique moléculaire et la mesure de la cinétique par fluorescence.
Il en ressort que les Nups, molécules flexibles en mouvement constant, interagissent avec les transporteurs de manière très ponctuelle, au niveau de leurs résidus phénylalanines. Ces interactions locales n'affectent ni la flexibilité globale de la nucléoporine ni sa dynamique. Individuellement, il s'agit de couplages – et découplages – ultrarapides, de faible affinité mais spécifiques. La multiplicité de ces interactions faibles assure une affinité globale suffisante, et leur constant renouvellement permet le passage rapide du transporteur. Ce résultat acquis sur les pores nucléaires pourrait contribuer à éclairer de nombreux autres phénomènes d'interaction dans lesquels sont impliquées des protéines désordonnées.
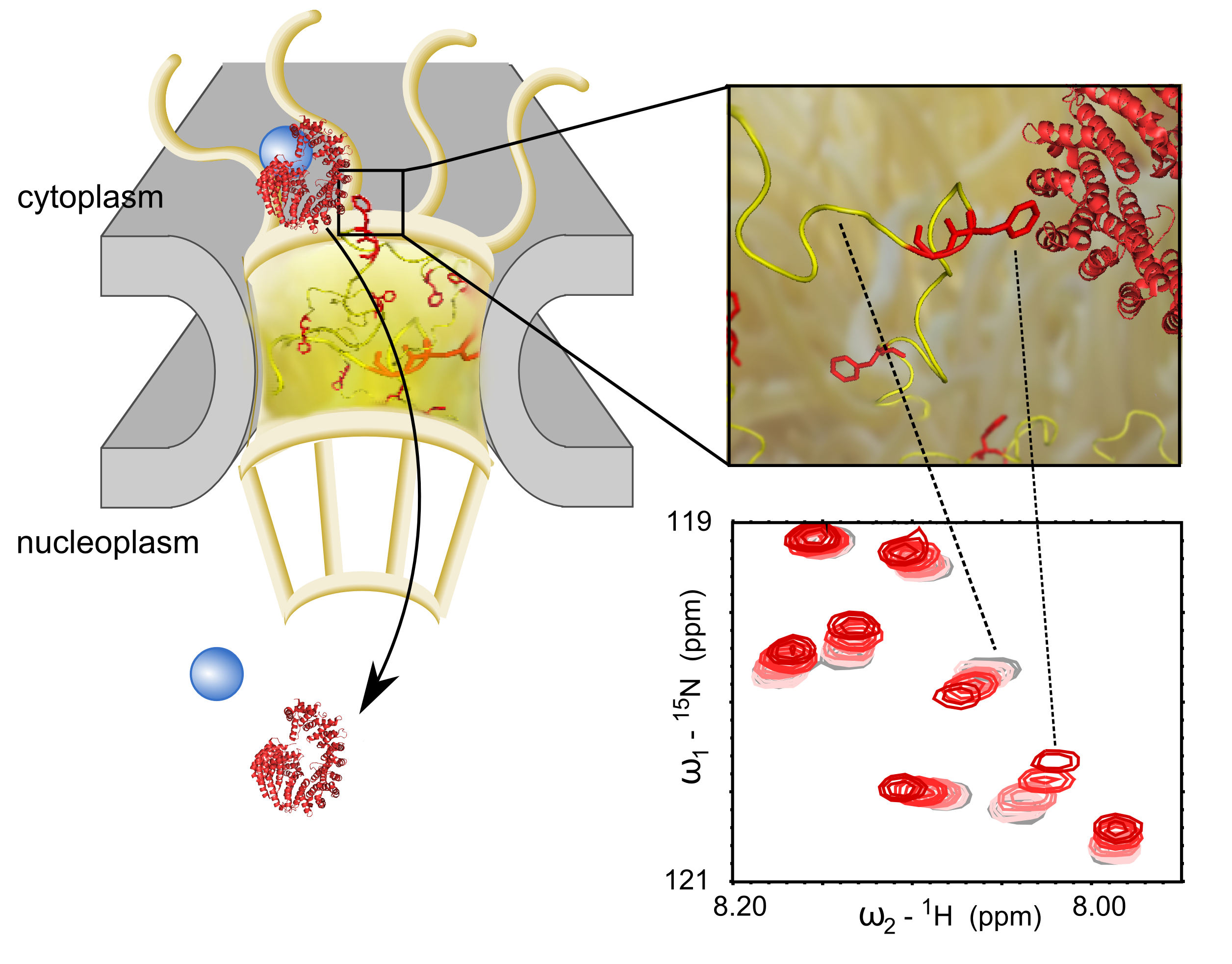
Schéma d’un pore nucléaire et du transit d’une molécule (en bleu) entre le cytoplasme et le noyau. En rouge, les transporteurs, en jaune, les nucléoporines. Ces dernières jouent un rôle de filtre dans le pore de l’enveloppe nucléaire. A droite : les expériences en RMN ont permis d’identifier les zones d’interactions entre les transporteurs et les nucléoporines. En haut, une illustration de l’interaction, en bas un zoom dans les spectres RMN montrant l’interaction par acide aminé de la nucléoporine. © Sigrid Milles / CEA
1 protéines sans structure tridimensionnelle stable
2 deux acides aminés parmi les 20 qui forment l'ensemble des protéines
3 les ions et petites molécules diffusent librement à travers le pore