La maladie d’Alzheimer reste aujourd'hui incurable. Seuls quatre médicaments sont disponibles mais ils ne réduisent que partiellement certains symptômes. Pourquoi la communauté scientifique a-t-elle tant de mal à concevoir des thérapies efficaces ? « Les mécanismes mis en jeu dans la maladie d’Alzheimer sont complexes, explique Jérôme Braudeau, chercheur au CEA-I2BM. Les manifestations biologiques de la maladie apparaissent bien avant (parfois 20 ans) la pose du diagnostic clinique. Il est donc difficile d’analyser le fonctionnement du cerveau d’un patient pour comprendre à l’échelle cellulaire les altérations initiales dont il est victime. Or la compréhension de cette phase infraclinique pourrait être une étape décisive pour le développement de molécules thérapeutiques efficaces.» Les chercheurs mènent ainsi deux stratégies en parallèle : le développement de méthodes biochimique ou d’imagerie performante et non invasive pour sonder le cerveau des patients d’une part, et la mise au point des modèles animaux au plus proches de la pathologie humaine d’autre part.
« Les modèles animaux actuels sont inadaptés vis à vis de la pathologie humaine, déplore le neurobiologiste. Ce manque de pertinence constitue un facteur limitant au développement de médicaments efficaces à visée curative. Nous avons mis au point un modèle rongeur qui évite certains écueils des modèles actuels. »
La maladie d’Alzheimer se caractérise par l’agrégation de protéines tau dans les neurones d’une part, et par l’apparition de plaques de peptides b-amyloïde à l’extérieur des neurones d’autre part. « Ces plaques amyloïdes ne seraient qu’une manifestation tardive de la pathologie, souligne Jérôme Braudeau. Les peptides délétères, dénommés peptides Ab42, seraient initialement solubles et exerceraient directement leur effet toxique sur les neurones, les rendant moins performants. Leur production continue pendant des années pourrait secondairement aboutir à leur agrégation sous forme de plaques amyloïdes.»
Les chercheurs ont alors conçu un modèle de souris par transfert de gènes permettant de mimer l’apparition, à l’âge adulte, de peptides solubles Ab42 dans l’hippocampe, structure cérébrale qui sous-tend les mécanismes de mémorisation. Ils ont ensuite testé la pertinence de leur modèle en le comparant à ceux utilisés actuellement par la communauté scientifique et aux données accessibles sur la pathologie humaine. Tout d’abord, la concentration des peptides Ab42 dans l’hippocampe s’avère plus cohérente avec la pathologie humaine que celle d’autres modèles. En outre, les chercheurs ont effectué des tests électro-physiologiques pour évaluer la perte de capacité des neurones à fonctionner en réseau, ce qui apparaîtrait dès les premiers stades de la maladie. « Là aussi nos résultats sont parfaitement compatibles avec la progression de la maladie chez l’Homme », affirme le biologiste. Enfin, des tests cognitifs effectués sur les animaux ont également montré des performances précocement altérées dans ce modèle. Ces différentes caractéristiques font de ce modèle un outil de choix pour étudier les atteintes initiales dans la maladie d’Alzheimer.
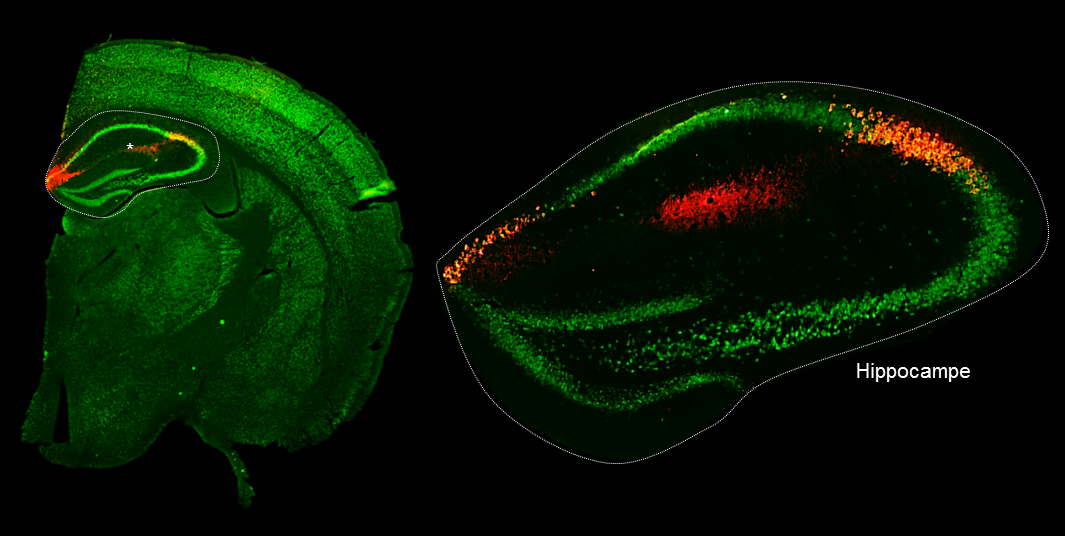
Micrographie d’un hémisphère (à gauche) de souris après injection d’un virus AAV portant le gène de l’APP. Seules deux régions de l’hippocampe (à gauche) vont produire l’APP puis l’Aβ42. L’Aβ42 soluble ainsi produit va diffuser dans l’intégralité de l’hippocampe. (c) Mickaël Audrain, CEA/I2BM/Inserm