Les microbiologistes ont longtemps scindé le monde biologique en deux catégories : les eucaryotes, organismes multicellulaires dont nous faisons partie, et les procaryotes, organismes unicellulaires. Or, cette seconde catégorie mérite davantage d’égards car elle regroupe deux espèces bien différentes : les bactéries et les archées. Ces dernières ont une biologie différente des bactéries[1]. On les retrouve dans les milieux extrêmes (anaérobies, à forte salinité, très chauds ou à grande profondeur), mais pas seulement. Les archées représenteraient pas moins de 20% des procaryotes en biomasse sur notre Terre ! Elles sont aujourd'hui considérées comme le troisième domaine du Vivant.
Des chercheurs de l´institut Max Planck (Allemagne), de l’Institut de Biologie Structurale et de l´ENS de Lyon ont déterminé la structure du complexe d’enzymes responsable de la synthèse du mévalonate, brique de base constituant la membrane des Archées. La première réaction de cette synthèse, catalysée par l’enzyme thiolase, est très endergonique (le flux de production est très faible, la réaction nécessite un apport d’énergie pour avoir lieu) ce qui est en contradiction avec la vitesse de croissance rapide des archées, et donc de leur synthèse lipidique. Les chercheurs ont joint leurs efforts pour dévoiler l´astuce moléculaire qui permet aux archées d´accélérer la vitesse de la thiolase. En la purifiant directement à partir de cellules d´archée, les chercheurs se sont aperçu que cette enzyme forme un complexe naturel avec l´HMGCS, la deuxième enzyme de la biosynthèse du mévalonate. Les deux enzymes sont maintenues ensemble par une troisième petite protéine connectrice (appelée DUF35). En utilisant le Tb-Xo4, un nouvel outil induisant la cristallisation et facilitant fortement la détermination structurale, et la technique de diffraction de rayons-X de cristaux de protéines sur la ligne de lumière PROXIMA-2A, la structure du complexe protéique thiolase/HMGCS/DUF35 a été résolue.
Outre le caractère fondamental de cette découverte, ces résultats intéressent aussi le domaine de l’industrie, le mévalonate étant une molécule utilisée pour la synthèse de nombreuses substances chimiques.
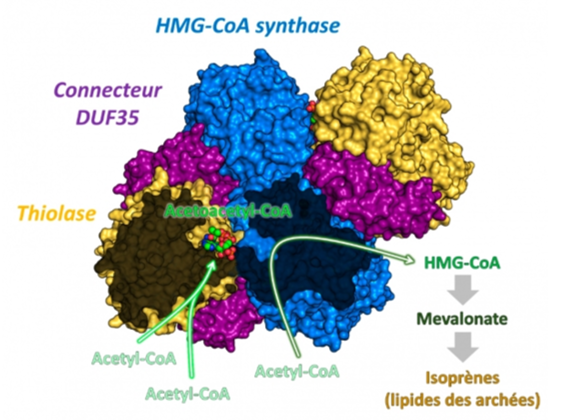
Structure tridimensionnelle du complexe protéique thiolase-HMGCS unifié par la protéine DUF35 et mécanisme réactionnel proposé.
|1] Par exemple, certaines de leurs enzymes et une partie de leur matériel génétique ressemblent davantage à ceux des eucaryotes que ceux des bactéries.