L'adsorption des protéines sur les surfaces inorganiques est une question fondamentale avec de multiples implications dans le domaine des prothèses, bio senseurs, nanoparticules, etc.... L'utilisation croissante de nanoparticules manufacturées, notamment dans l'industrie alimentaire avec le dioxyde de titane (E171) ou la silice (E551) pose la question de leur devenir biologique une fois ingérées. La taille nanométrique (< 100 nm) des nanoparticules leur confère une surface spécifique très élevée et la capacité à rentrer dans les cellules.
Au contact d'un milieu biologique (cellule, fluides intra- ou extracellulaires), les nanoparticules ne restent pas nues, mais se recouvrent d'une ou plusieurs couches de protéines. C'est cette nouvelle entité qui est prise en charge par l'organisme et qui conditionne sa bio-distribution et sa toxicité potentielle. Dans ce contexte, l'équipe interdisciplinaire de nano-toxicologie moléculaire composée de chercheurs des instituts Joliot et Iramis s'intéresse depuis plusieurs années à l'adsorption des protéines sur les nanoparticules par des méthodes de physico-chimie, protéomique, biologie moléculaire, bioinformatique, modélisation et dynamique moléculaire.
Au cours de travaux précédents, l'équipe a montré que pour des surfaces électronégatives telles que la silice, l'électrostatique gouverne le processus d'adsorption, favorisant la liaison de protéines riches en arginine (Arg) , un acide aminé participant à la traduction des gènes en protéines. Les propriétés dynamiques sont également importantes, puisque les protéines fortement structurées, sont peu à même de se déformer au contact de la silice et donc de s'adsorber, contrairement aux protéines flexibles et/ou désordonnées. Parmi ces dernières, pour celles ayant une forte propension à s'adsorber, il s'avère aussi que c'est aussi le groupe des protéines participant à la traduction qui est le plus représenté, et particulièrement une sous-classe d'entre elles, les protéines à motifs RGG (Arg-Gly-Gly). L'équipe montre dans cette étude que leur forte affinité pour la silice est due à ces motifs. Ces résultats ont été obtenus par des approches complémentaires ex vivo, in vitro et in silico.
Ces résultats sont importants pour le développement d'approches « safe by design ».
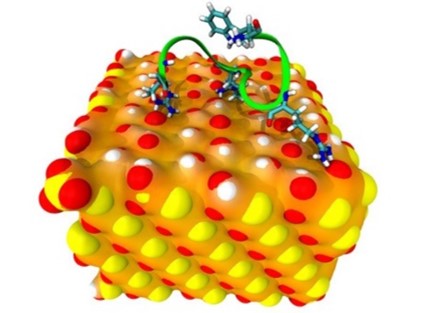
Interactions obtenues au cours des calculs de dynamique moléculaire entre un peptide contenant 3 arginines et une surface de silice. Le squelette du peptide est représenté en mode ruban vert, les arginines et le tryptophane terminal sont représentés en mode bâton. Sur la surface de silice, les atomes de silicium sont représentés en jaune, les atomes d'oxygène en rouge et d'hydrogène en blanc. © CEA