Douleur aiguë ou chronique, douleur inflammatoire ou neuropathique[1], près de deux tiers des consultations médicales seraient motivées par des douleurs. La douleur, cette « expérience sensorielle et émotionnelle désagréable, associée à une lésion tissulaire réelle ou potentielle, ou décrite dans ces termes »[2] est depuis plusieurs années un enjeu de santé publique. Les antalgiques (paracétamol, aspirine, morphine et dérivés) sont les médicaments les plus prescrits pour les prendre en charge. Mais même ceux qui nous paraissent les plus anodins – car largement utilisés – ne sont pas sans effet indésirable. Une partie des recherches actuelles vise à trouver de nouvelles molécules aux propriétés antalgiques. Et pourquoi ne pas aller chercher directement dans la nature ? Serpents, scorpions, araignées, cônes de mer… près de 170 000 espèces fabriquent un venin, cocktail complexe de toxines, dont certaines sont déjà connues pour leurs propriétés antinociceptives[3].
Le CEA-Joliot exploite l’immense ressource que constituent ces toxines. En collaboration avec Sanofi R&D, Smartox Laboratories et l’Institut du Thorax (Nantes), il a criblé une banque de venins à la recherche de toxines capables de bloquer un sous-type de canal sodium (Nav1.7), important pour la transmission nerveuse de la douleur. Les canaux sodium font partie de la famille des canaux ioniques, des protéines transmembranaires qui contribuent notamment à la propagation de l’influx nerveux. Le sous-type Nav1.7 suscite l’intérêt, en partie car des mutations de ce canal ont été identifiées comme liées à des phénotypes « sans douleur » ou au contraire « hyperalgésiques ».
Les chercheurs ont criblé une banque de 117 venins (serpents, araignées, scorpions, guêpes, abeilles, amphibiens, lézards et poissons) et testé leur capacité à inhiber Nav1.7. Un peptide issu du venin d’une tarentule de Malaisie (Cyriopagopus schioedtei) s’est avéré être le plus efficace. Sa séquence a été déterminée par spectrométrie de masse. Il contient 33 acides aminés et a été nommé "cyriotoxine-1a". Les chercheurs ont réussi à en faire sa synthèse chimique et ont montré que cette version synthétique avait la même capacité d’inhibition de Nav1.7 que le peptide naturel. Ils ont également déterminé sa structure tridimensionnelle par résonance magnétique nucléaire (RMN). Surtout, afin d’obtenir des informations supplémentaires sur ses propriétés fonctionnelles, plusieurs expériences ont été conduites, sur des neurones en culture et dans un organisme modèle. Des groupes d’animaux auxquels la toxine ou un placebo a préalablement été injecté ont été comparés lors de tests de sensibilité mécanique ou thermique à la douleur. Les données collectées confirment l’effet antinociceptif du peptide.
Le profil pharmacologique de la cyriotoxine-1a, déterminé dans cette étude, ouvre la voie à des études d’ingénierie visant à optimiser son potentiel analgésique.
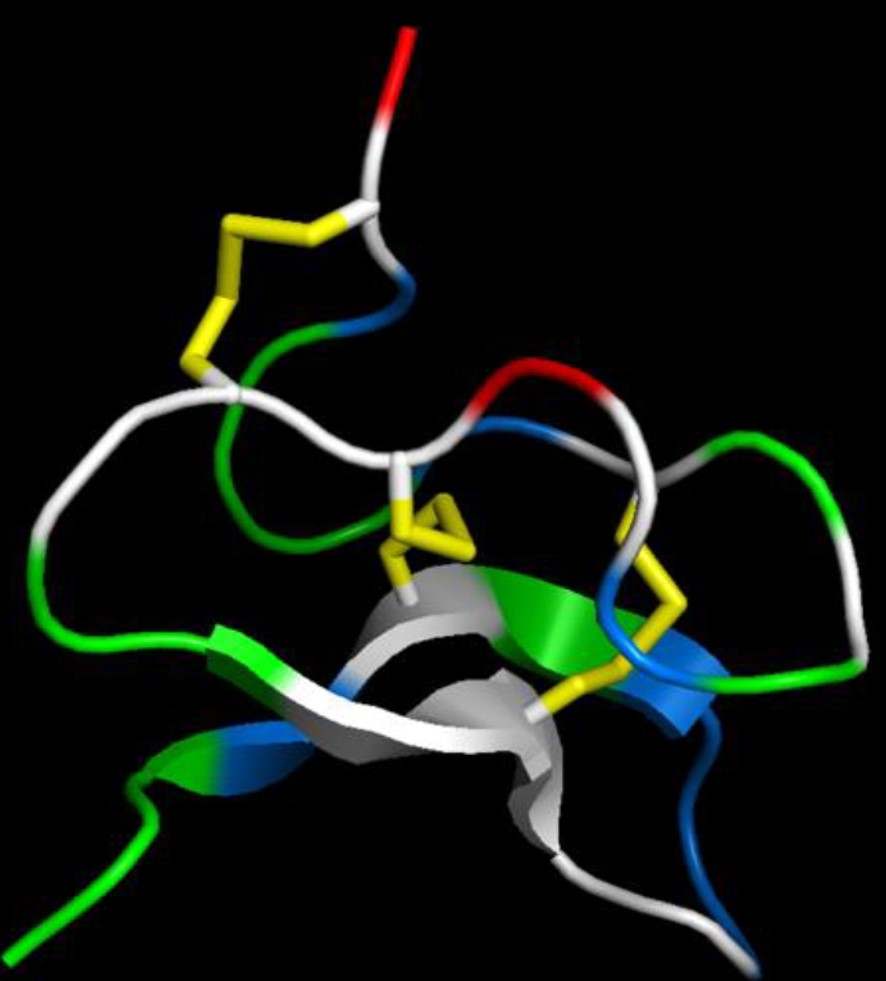
Représentations schématique du repliement du squelette peptidique de la cyriotoxine-1a déterminé par RMN. La topologie comporte un feuillet bêta antiparallèle. Les 3 ponts disulfures établis entre des cystéines sont colorés en jaune. Les résidus hydrophobes, basiques et acides sont respectivement colorés en vert, bleu et rouge. La structure a été réalisée avec le logiciel PyMol. © T.C. Gonçalves et al. 2019 / BJPharm