Les protéines fluorescentes vertes (GFP) sont des protéines utilisées comme marqueurs (génétiquement encodés) pour permettre de localiser jusqu’aux protéines individuelles par microscopie optique. Leur fluorophore est formé de trois acides aminés et il se trouve au centre d’un tonneau ß qui le protège de l’environnement. Bien que les GFP soient dotées d’un remarquable rendement d’absorption et de fluorescence, leur fluorophore est capricieux et fragile. Ainsi, il peut entrer dans des périodes dites « obscures » d’inactivité temporaire et après environ 100000 cycles d’excitation et d’émission, il s’éteint définitivement.
A l’IBS, l’équipe Pixel a déjà résolu les structures de certains de ces états obscurs. Ils montrent tous des modifications chimiques plus ou moins sévères, ce qui pose la question de leur irréversibilité. On soupçonnait un état en amont où ces modifications ne sont pas encore irréversibles et dont la connaissance permettrait d’améliorer le comportement des GFP. Mais cet état était mal connu : quel est son caractère chimique (triplet, radical, biradical ?), son rendement (pour cents, pour milles ?), son temps de vie (nano-, micro-, millisecondes ?), sa réactivité (oxydative, réductive, les deux ?), et son spectre d’absorption (UV, VIS, IR ?).
Grace à une collaboration avec l’équipe de Klaus BrettelL à l’I
2BC (CEA Saclay), l’équipe Pixel du groupe DYNAMOP de l’IBS a soumis l’EGFP – protéine fluorescente paradigmatique - à des études par spectroscopie d’absorption transitoire. Il s’agit d’une technique peu appliquée auparavant aux protéines fluorescentes, que les chercheurs ont poussée aux limites de sa résolution. Cela leur a permis de détecter la signature spectrale de l’état obscur « fantôme » et de le caractériser en répondant à tous les questionnements évoqués ci-dessus. Ces avancées ouvrent la voie pour mieux comprendre le fonctionnement photophysique des protéines fluorescentes et alimentent l’espoir de trouver des clés pour leur optimisation continue.
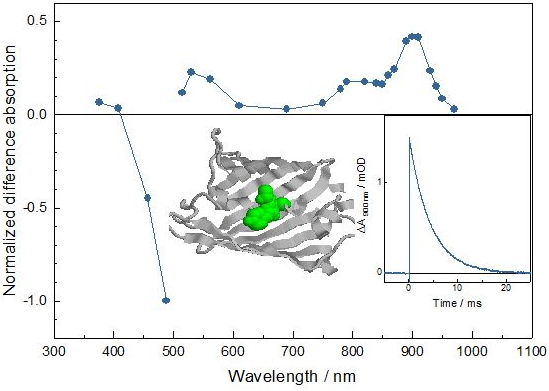
Structure du fluorophore de l'EGFP, spectre d'absorption triplet et cinétique de décroissance.