Les télomères, régions de l’ADN (hautement répétitives donc a priori non codantes) situées sur les extrémités des chromosomes, jouent un rôle important dans la division cellulaire, la cancérogenèse et le vieillissement. Leur fonction biologique peut être perturbée par des dommages oxydatifs, que l’on pensait uniquement provoqués par l’interaction de l’ADN avec d’autres molécules (issues du métabolisme ou reliées à la pollution et la prise des médicaments) agissant comme oxydants. Dans le cadre du projet ANR OPHID coordonnée par le LIDYL (IRAMIS) et à laquelle participe le SyMMES de notre institut, il est montré que la lumière ultraviolette de basse énergie, absorbée directement par de l’ADN télomérique, génère des radicaux conduisant à des dommages oxydatifs
[1].
La perte d’un électron sur l'une des bases d'un brin d'ADN génère des radicaux à l’origine de dommages qualifiés "d'oxydatifs". Un tel effet se produit typiquement par des réactions d’oxydoréduction, mais aussi suite à l’absorption d’un photon ionisant, pourvu que son énergie soit supérieure au potentiel d’ionisation directe (transition verticale) des bases, qui constituent l’alphabet du code génétique : λ < 200 nm, E > 6 eV : photons UV et au-delà. Une étude récente montre que ce seuil doit être considérablement abaissé, puisqu'elle met en évidence la formation d'un marqueur (8-oxo-guanine) bien connu des dommages oxydatifs, suite à l’irradiation de l’ADN génomique à 295 nm. Cette longueur d'onde correspond à une énergie de 4,2 eV, dans la gamme du rayonnement UVB du Soleil qui arrive sur la surface de la Terre. Le mécanisme associé implique des radicaux cationiques
[2].
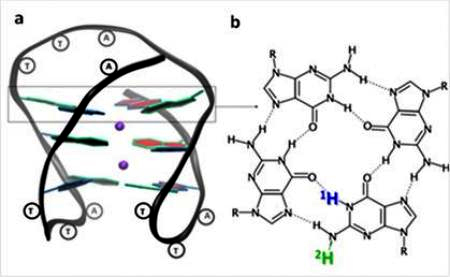 Figure 1 : G-quadruplex d'une hélice ADN, formé par la séquence télomérique humaine GGGTTAGGGTTAGGGTTAGGG ; les guanines (G) s’associent entre elles par des liaisons hydrogènes en formant des tétrades (b). Après photo-ionisation, la perte d'un proton (bleu ou vert) conduit à la formation de deux radicaux déprotonés différents.
Figure 1 : G-quadruplex d'une hélice ADN, formé par la séquence télomérique humaine GGGTTAGGGTTAGGGTTAGGG ; les guanines (G) s’associent entre elles par des liaisons hydrogènes en formant des tétrades (b). Après photo-ionisation, la perte d'un proton (bleu ou vert) conduit à la formation de deux radicaux déprotonés différents.
Afin de mieux comprendre les dommages oxydatifs provoqués par le rayonnement UV sur les télomères de l'ADN, les chercheurs ont entrepris une étude quantitative des électrons émis et des radicaux formés lors de l'irradiation. Pour ceci, ils ont utilisé la spectroscopie d’absorption résolue en temps, qui permet d'identifier les espèces radicalaires transitoires par leur spectre d'absorption, couplée à des calculs de chimie quantique. La séquence télomérique humaine, capable de se replier en formant des structures à quatre brins appelées G-quadruplexes, a été plus particulièrement étudiée. Le rendement quantique observé pour l’ionisation à un photon à 266 nm (4,66 eV) est de 4,5 x 10
-3, comparable à celui d’autres phototoréactions telles que la dimérisation des bases, bien connues comme source d'endommagement de l’ADN dans ces conditions.
Suite à l’éjection d’électrons, les radicaux transitoires, observables au sein du G-quadruplex, sont identifiés par leur spectre d'absorption. Le radical cation initialement formé peut soit directement réagir chimiquement, soit simplement perdre un proton. Cette perte rend le radical électriquement neutre, avant qu'il ne réagisse selon d'autres voies. Ainsi, en moins de 2 µs, 50% des radicaux cations initiaux perdent leur proton qui n’est pas engagé dans une liaison hydrogène (en vert sur la figure 2). Ces radicaux disparaissent en moins de 5 ms. De façon inattendue, une autre voie de déprotonation du radical cation est observée, avec la perte du proton interne bleu, qui se produit en 5 ms. La durée de vie de ce radical neutre est beaucoup plus longue, de l'ordre de 50 ms.
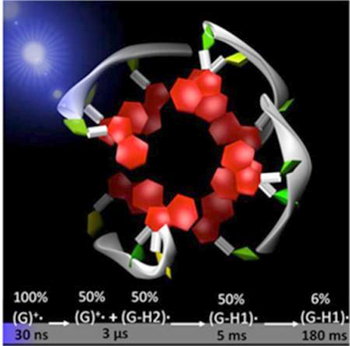 Figure 2 : Evolution de la population (en %) des différentes radicaux identifiées : (G)+. : radical cation - (G-H2). : radical déprotoné, avec perte de l'atome d'hydrogène externe - (G-H1). : radical déprotoné, avec perte de l'atome d'hydrogène interne.
Figure 2 : Evolution de la population (en %) des différentes radicaux identifiées : (G)+. : radical cation - (G-H2). : radical déprotoné, avec perte de l'atome d'hydrogène externe - (G-H1). : radical déprotoné, avec perte de l'atome d'hydrogène interne.
Plusieurs conclusions importantes ont été tirées de ce travail :