Très présent dans les océans archéens, le nickel est désormais retrouvé à des concentrations de l’ordre du nanomolaire dans la plupart des environnements. Ainsi, plusieurs enzymes à nickel ont une origine ancestrale. Elles sont apparues sur Terre dans des milieux riches en fer, nickel, H2, CO ou CO2 et leur présence est essentielle dans des processus divers. Parmi elles, la monoxyde de carbone déshydrogénase (CODH) catalyse de façon réversible l’oxydation du CO en CO2. Elle joue un rôle central dans le métabolisme du carbone chez les microorganismes anaérobies. L’intérêt porté aux enzymes à nickel telles que la CODH s’est développé ces dernières années en raison de la recherche de nouvelles énergies et du développement de nouvelles méthodes de séquestration du CO2. D’un point de vue fondamental, la compréhension de la voie de biosynthèse de ces métalloenzymes est devenue un sujet ambitieux dans le domaine de la chimie bio-inorganique.
Le site actif de la CODH est unique en biologie et sa biosynthèse intrigue à la fois les chimistes et les biologistes. La structure cristallographique de la CODH a révélé la nature de son site actif, constitué de fer, de soufre et de nickel [1]. L’étape clef de l’activation de l’enzyme correspond à l’insertion du nickel au sein de l’enzyme. Cette étape nécessite l’intervention de trois protéines accessoires, CooC, CooJ et CooT ; les deux dernières ayant été décrites uniquement chez la bactérie Rhodospirillum rubrum.
Récemment, l’équipe Biocatalyse du laboratoire Chimie et Biologie des Métaux a révélé grâce une analyse phylogénétique l’existence de 111 homologues de CooT, reliés au métabolisme du nickel chez les bactéries et les archées anaérobies. La signature de ces protéines est la conservation stricte de la cystéine en position 2. Une histidine, partiellement conservée, est également présente dans la région C-terminale de la protéine. La caractérisation biophysique et structurale de CooT de R. rubrum a révélé que la protéine est capable de lier spécifiquement un ion nickel par dimère, et ceci uniquement grâce à la cystéine 2 [2]. Par la suite, les chercheurs de cette équipe, en collaboration avec l’équipe BioMet du même laboratoire, ont identifié et caractérisé la protéine CooT synthétisée par une autre bactérie (Carboxydothermus hydrogenoformans), révélant alors un deuxième mode de fixation du nickel qui implique la cystéine et l’histidine [3]. Les chercheurs ont ainsi identifié une nouvelle famille de protéines à nickel dont les membres possèdent deux motifs distincts de coordination du nickel.
Cette étude permet de déchiffrer la biosynthèse de la CODH afin de comprendre comment l’enzyme est maturée et son site actif formé.
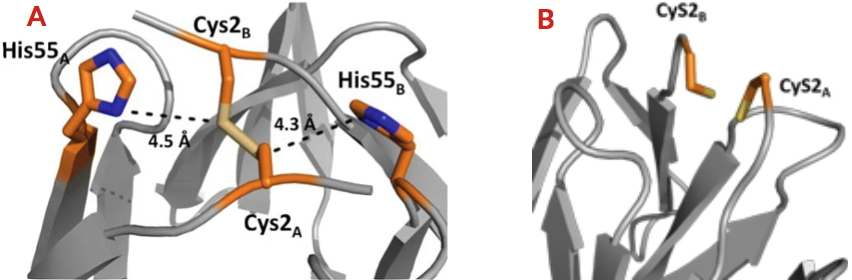
A - Site de fixation du nickel de CooT de Carboxydothermus hydrogenoformans.
B - Site de fixation du nickel de CooT de Rhodospirillum rubrum.