Le site actif de nombreuses enzymes est profondément enfoui dans leur cœur qui abrite un réseau de tunnels permettant le transport des substrats/entre la surface de l’enzyme et leur site actif. L’architecture de ces tunnels influence fortement le fonctionnement de ces enzymes. Pour en comprendre le mécanisme, il est essentiel de décrypter la relation structure/fonction des systèmes de tunnels. L’étroitesse, la sinuosité et l’état transitoirement ouvert de ces tunnels rendent leur étude difficile dans les structures cristallographiques.
Les hydrogénases catalysent réversiblement la réduction de 2 protons en hydrogène moléculaire. Elles permettent la production d’hydrogène chez certains microorganismes et peuvent servir de catalyseurs dans les bio-piles. Dans ces enzymes, l’hydrogène diffuse vers/depuis le site actif
via des tunnels hydrophobes. La plupart des hydrogénases opèrent en conditions anaérobies car l’oxygène inactive l’enzyme. L’hydrogénase-[NiFe] de
Ralstonia eutropha (ReMBH) est tolérante à l’O2, et est donc intéressante pour des applications biotechnologiques.
Une collaboration des chercheurs du laboratoire Chimie et Biologie des Métaux, de l’IBS, de l’ESRF et de l’hôpital universitaire de la Charité de Berlin a permis d’étudier la relation entre l’architecture des tunnels de ReMBH et sa tolérance à l’oxygène. Pour cette étude, ils ont développé des méthodes de marquage des tunnels à oxygène dans les enzymes cristallisées. En introduisant de l’oxygène ou du krypton sous pression dans les cristaux d’enzyme, ils remplissent de gaz les sites d’affinités pour l’oxygène et l’hydrogène, qui, par contraste avec la protéine, révèlent sans ambiguïté la structure des canaux.
Les chercheurs ont ainsi cartographié les tunnels de ReMBH (figure A), ce qui leur a permis de montrer que l’oxygène emprunte ces mêmes voies que l’hydrogène (figure B). Une comparaison structurale entre différentes hydrogénases a montré que les enzymes tolérantes à l’O2 contiennent un réseau de canaux plus étroits et avec moins d’embranchements que leurs homologues sensibles. Cette caractéristique permet vraisemblablement une meilleure sélectivité de l’hydrogène. Des simulations de Dynamique Moléculaire ont démontré que le système de tunnels de ReMBH possède un mécanisme discriminant qui favorise la diffusion directe de l’hydrogène entre le solvant et le site actif, mais qui réoriente l’oxygène préférentiellement vers des branches secondaires, protégeant ainsi partiellement l’enzyme de l’inactivation.
La compréhension de l’architecture des tunnels (figure C) est essentielle pour améliorer les propriétés de l’hydrogénase ReMBH. En modifiant l’ouverture et l’hydrophobicité des tunnels il est envisageable d’augmenter l’accessibilité de l’hydrogène et la tolérance de l’enzyme à l’oxygène.
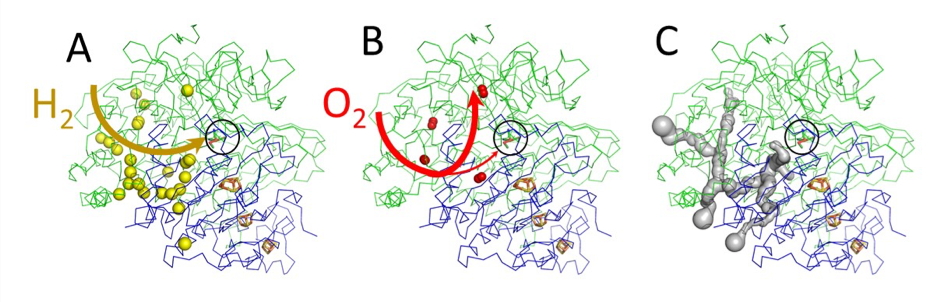
A - Marquage au krypton de l’hydrogénase ReMBH, accès de l’hydrogène au site actif.
B - Chemin de l’oxygène.
C - Modélisation du réseau de tunnels.