La microscopie de fluorescence à super-résolution permet d'observer la matière vivante à l'échelle nanoscopique d'un point de vue structural et dynamique. Dans ce dernier cas, il s'agit de suivre des molécules cibles individuelles lorsqu'elles diffusent dans une cellule, en employant une technique appelée
sptPALM (single-particle-tracking localization microscopy). Cependant, un important obstacle à cette technique provient de l'imperfection des protéines fluorescentes qui ont tendance à "clignoter", c’est-à-dire à s'éteindre de manière transitoire, ce qui fait facilement perdre la trace des molécules individuelles. Existe-t-il une stratégie pour réduire ou éliminer ce problème ?
Des chercheurs de notre institut, en collaboration avec l'Université Catholique de Leuven en Belgique, ont entrepris d'étudier la nature du clignotement (blinking) chez mEos4b, la dernière variante d'une série de protéines fluorescentes photo-convertibles vert à rouge très utilisées en microscopie super résolution.
Par une approche mécanistique combinant la cristallographie aux rayons X, la spectroscopie optique et l'analyse des traces de fluorescence de molécules uniques, les travaux ont révélé une source majeure de clignotement liée à un phénomène de photochromisme. Suite à l'excitation par le laser 561 nm du microscope, les protéines fluorescentes peuvent changer de conformation et passer transitoirement dans un état non fluorescent. L'étude de cet état a ensuite révélé sa forte sensibilité à la lumière de couleur cyan. Ainsi une faible illumination de l'échantillon avec un laser cyan à 488 nm force un retour rapide vers l'état fluorescent, réduisant considérablement la durée de vie de l'état non fluorescent, et par conséquent l'intensité du clignotement.
Étant donné que la plupart des instruments de sptPALM possèdent un laser 488 nm, une illumination additionnelle à cette longueur d'onde est très facile à réaliser, apportant une forte amélioration de la qualité des données avec un effort minimal. Dans leur article, les chercheurs ont ainsi pu étudier la diffusion de la protéine MAP4 (microtubule associated protein 4), qui interagit avec les microtubules, d'une manière beaucoup plus précise qu'auparavant. Ils tentent maintenant d'appliquer leur stratégie de suppression des clignotements à la question du comptage moléculaire par imagerie qPALM (quantitative Photo-Activated Localization Microscopy).
Dans ce travail, la compréhension mécanistique de l'origine du phénomène de clignotement de mEos4b, grâce à des techniques avancées de biologie structurale, a permis d'apporter une solution simple à une problématique de microscopie en biologie cellulaire. Il s'agit donc d'un cas d'école démontrant tout le potentiel méthodologique d'une approche intégrative entre biologies structurale et cellulaire.
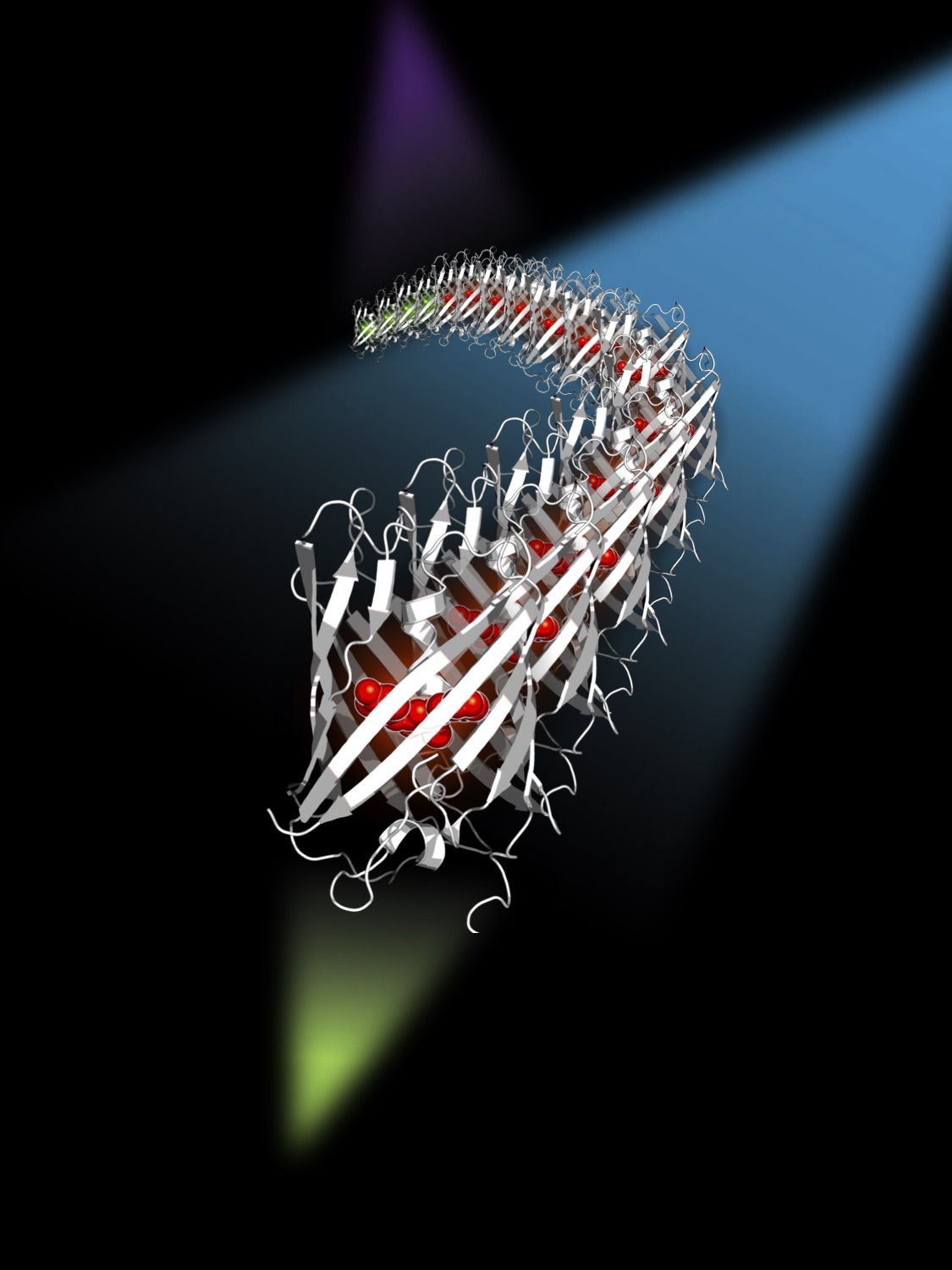
Vue d'artiste de la protéine mEos4b diffusant au sein d'un échantillon, et illuminée par trois lasers à 405 nm, 488 nm et 561 nm. Le laser 488 nm supprime le clignotement de mEos4b.
sptPALM : dans cette technique, les molécules cibles sont le plus souvent marquées avec une protéine fluorescente "photo-convertible de vert à rouge". Les protéines fluorescentes individuelles, initialement à l'état vert, sont progressivement photoconverties à l'état rouge à l'aide d'un laser à 405 nm, et l'émission de fluorescence rouge est visualisée dans le temps au moyen d'un microscope à champ large de haute sensibilité et équipé d'un laser d'excitation à 561 nm, permettant de suivre la trace de chaque molécule cible.