Responsable : Fawzi Boumezbeur
L'équipe « Métabolisme cérébral et imagerie hétéronucléaire » s'intéresse à l'étude non-invasive de la physiologie et de la biochimie cérébrale chez l'homme et chez les modèles animaux. Pour cela, nous développons l'imagerie et la spectroscopie RMN de noyaux d'intérêt en biologie ou pharmacologie tel que proton (1H), le carbone-13 (13C), le lithium-7 (7Li), le phosphore (31P) et le sodium (23Na).
La Spectroscopie RMN (SRM) in vivo du 1H et du 31P permet de détecter et mesurer de façon non-invasive la concentration de composés biologiques pertinents pour l'étude du métabolisme énérgétique (phosphocreatine, ATP), la neurotransmission (glutamate, GABA), les densités neuronale (N-acetyl-aspartate) et gliale (myo-inositol) ou le métabolisme membranaire (phospho-choline, glycero-phospho-choline). Ainsi l'analyse des profils biochimiques 1H (figure 1) ou 31P permet d'étudier longitudinalement l'évolution de la physiologie cérébrale en conditions pathologiques ou normales.
Le 13C est un isotope peu abondant (1%) mais stable du carbone, détectable par RMN. Etant donnée l'omniprésence des atomes de carbones dans notre corps, il est possible d'utiliser des substrats énergétiques enrichis en 13C (comme le glucose, l'acétate ou le lactate) pour sonder certains flux métaboliques (figure 2) tels que la glycolyse, le cycle de Krebs, la synthèse et le recyclage des principaux neurotransmetteurs excitateurs et inhibiteurs : le glutamate et le GABA.
Figure 2. Spectroscopie RMN dynamique du 13C in vivo. © UNIRS NeuroSpin CEA
Le sodium est le second noyau le plus concentré possédant un spin non-nul. Il est présent sous forme ionique (Na+) dans les cellules et dans le milieu extracellulaire, et joue un rôle physiologique majeur dans l'équilibre osmotique des cellules et dans la propagation des potentiels d'action notamment via l'activité de la pompe Na/K ATPase. Par conséquent, l'IRM cérébrale in vivo du 23Na et l'étude de sa compartimentation intra/extracellulaire peuvent nous renseigner sur l'homéostasie cellulaire et la viabilité des tissus cérébraux dans certaines pathologies telles que l'ischémie, les tumeurs ou des affections neuro-inflammatoires comme la sclérose en plaques.
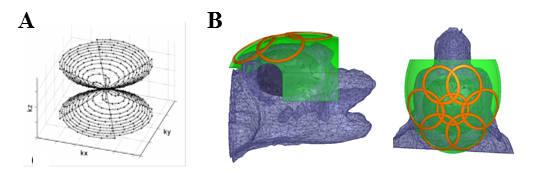 | Figure 3. Stratégie spirale 3D d'acquisition du plan de Fourier (A) et prototype d'antenne 23Na en cours d'évaluation pour l'imagerie cérébrale du macaque à 7T (B). Illustration d'après (Riemer et al, MAGMA 2013). © UNIRS NeuroSpin CEA |
Enfin, le lithium est le traitement de référence chez le patient bipolaire pour la prévention des phases maniaques avec une proportion significative de patients asymptomatiques pendant de nombreuses années. Cependant, le mécanisme d'action du lithium reste un mystère et nous ignorons pourquoi certains patients répondent plus ou moins bien au Li. Grâce à l'IRM et la SRM in vivo du 7Li, nous espérons étudier la biodistribution cérébrale du lithium chez des patients bipolaires afin d'identifier des biomarqueurs prédictifs de la réponse au traitement.
Ces travaux sont possibles car la détection de ces noyaux et métabolites peu concentrés (de l'ordre du millimole par litre) bénéficient d'une polarisation accrue à ultra-haut champ magnétique. Ainsi les IRM de NeuroSpin et en particulier l'aimant 11,7T Iseult offrent des perspectives uniques pour l'étude du métabolisme et de la physiologie par IRM/SRM des noyaux 1H, 13C, 7Li, 31P et 23Na (mais aussi Oxygéne-17 et Potassium-39).