04
GRAND ANGLE
n° 01 - mars 2014 -
CEAbio
Dès sa création, l’IBS se consacre aux pro-
cessus cellulaires fondamentaux (division
cellulaire, immunité innée, catalyse, etc.).
La synergie permanente entre moyens tech-
niques et biologie se reflète dans l’intitulé de
ses quinze groupes de recherche. Certains sont
construits autour d’une technique : microsco-
pie électronique, synchrotron ou RMN
). D’autres se consacrent à
des familles de protéines [transporteurs mem-
branaires, métalloprotéines (
...] ou à des questions de santé
). En réalité, beau-
coup d’équipes exploitent toute la chaîne des
plateformes, de la production de la protéine à
sa purification, en passant par la détermination
de sa structure et la compréhension de ses
mécanismes.
Un environnement technologique
unique pour les chercheurs
Avec la montée en puissance de la géno-
mique, au début des années 2000, l’heure est
désormais à la recherche systématique de
familles de protéines dans les génomes des
hôtes ou des agents pathogènes. Ces caractéri-
sations ne peuvent se faire «
à la main
»: s’ouvre
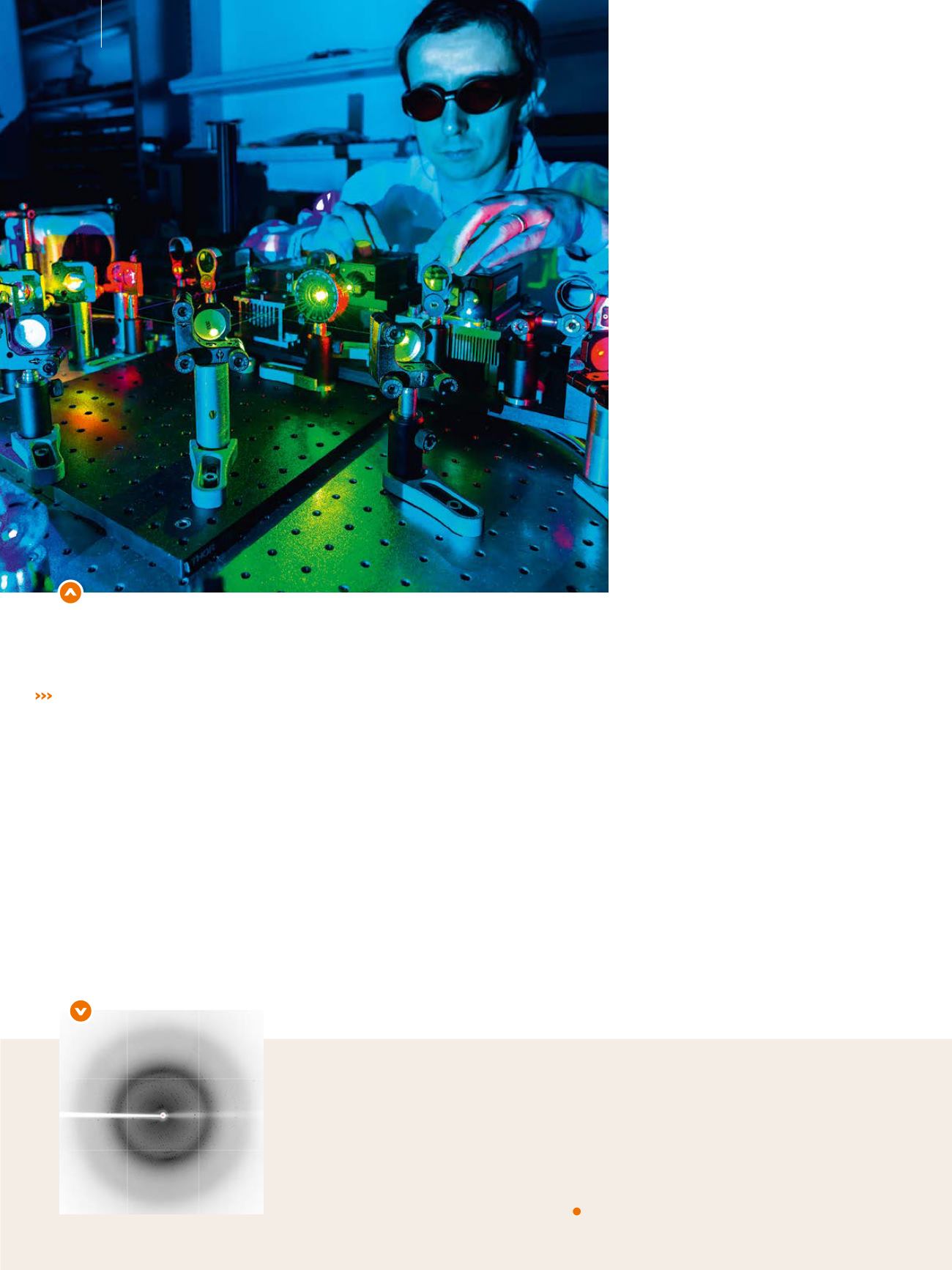
Alignement de lasers du microscope optique à super résolution de l’IBS, pour le suivi
dans les cellules de protéines d’intérêt marquées par fluorescence.
© CEA /
qui mise entre autre sur le développement de
médicaments capables de « bloquer les ser-
rures » de certaines protéines, enrayant ainsi
des mécanismes bien ciblés, par exemple le
développement de bactéries, la prolifération
de cellules cancéreuses...
Le CNRS et le CEA envisagent donc chacun,
en 1992, un programme de biologie structu-
rale. Tous deux pensent s’installer à Grenoble,
à proximité du synchrotron ESRF
1
– et de son
précieux rayonnement – alors en voie d’achève-
ment. «
Ils ont eu l’intelligence de créer conjoin-
tement l’Institut de biologie structurale, auquel
s’est ralliée l’Université Joseph Fourier en 1999
»
explique Eva Pebay-Peyroula, qui dirige l
aujourd’hui. «
D’autant que la discipline continue
de réclamer des moyens lourds en termes de
matériel et d’expertise
». En effet, si la biologie
structurale s’appuie toujours sur la cristallo-
graphie, elle requiert de nouveaux procédés
et équipements. Ses enjeux sont tels qu’au-
jourd’hui, elle nécessite des investissements
importants, et ses acteurs y compris au niveau
européen s’associent pour mutualiser moyens
et recherches (
.
Cliché de diffraction d’un cristal
d’enzyme (aspartate amino-
transférase), réalisé à l’ESRF.
© CEA/ESRF
Une protéine mesure quelques nanomètres. Trop minuscule pour pouvoir être
observée en 3D, elle est étudiée sous forme de cristal. Celui-ci, empilement de
milliers de milliards d’une même protéine dans une organisation spatiale précise,
correspond à cette protéine en format géant. Le cristal est exposé sous différents
angles à des rayons X de très courtes longueurs d’onde (rayonnement synchrotron).
Il dévie alors ces rayons, l’angle de déviation étant lié à la distance entre les atomes.
À chaque exposition correspond un « cliché de diffraction », dont l’ensemble permet
de reconstituer une image en 3D de la protéine.
La biocristallographie
•
130
chercheurs, ingénieurs,
techniciens.
•
75
post-docs et doctorants.
•
25
étudiants
(BTS, Licence, Master).
•
Près de
140
publications
scientifiques par an.
•
2
start up créées.
•
14
brevets déposés en vigueur.
L’IBS
en chiffres


