Résultat scientifique | Toxicologie nucléaire
Mimer des protéines pour mieux comprendre la toxicité de l’uranium
 CEA
CEA
Chapeau
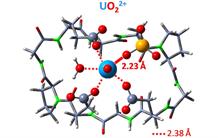
Des chercheurs de l'Inac ont analysé par une approche biomimétique les interactions de l'uranium avec les molécules biologiques impliquées dans la toxicité de cet élément. Les phosphoprotéines apparaissent comme des cibles prioritaires.
Publié le 10 octobre 2017
Corps de texte
L'uranium est un élément naturel abondant, présent dans de nombreux minerais et dans l'eau de mer. En dépit de cette omniprésence, l'uranium ne joue aucun rôle essentiel dans le vivant. Il présente une toxicité radiologique et chimique dont les mécanismes moléculaires sont encore mal compris.
L'ion uranium le plus stable in vivo est le cation uranyle UO22+ qui interagit préférentiellement avec quatre à six atomes d'oxygène dans le plan perpendiculaire aux liaisons O=U=O. Les chimistes de l'Inac ont choisi des séquences peptidiques courtes pour mimer les interactions protéine – métal et ainsi déterminer leurs caractéristiques structurales et thermodynamiques. Une structure peptidique cyclique contraignant les atomes d'oxygène donneurs d'électrons dans le plan équatorial de l'uranyle s'est avérée particulièrement efficace pour produire un édifice supramoléculaire dans lequel le peptide interagit avec l'uranyle (complexe d'uranyle).
En combinant synthèse, analyse chimique, spectroscopie d'absorption de rayons X et calculs théoriques, les chercheurs sont parvenus à corréler la séquence d'acides aminés de la structure cyclique et la stabilité du complexe d'uranyle obtenu. En particulier, les groupements phosphate (PO43-) renforcent significativement l'affinité des peptides biomimétiques avec l'uranyle. Les phosphoprotéines comme l'ostéopontine doivent donc être considérées comme des cibles potentielles de l'uranyle in vivo.
Haut de page