En France près d'un million de personnes sont atteintes de la maladie d'Alzheimer. Cette maladie, liée au vieillissement du cerveau et parfois associée à des prédispositions génétiques, résulte d'une lente dégénérescence des cellules du cerveau qui débute au niveau de l'hippocampe* avant de s'étendre au reste du cerveau, entraînant une perte progressive de la mémoire. Ces altérations sont associées à l'agrégation de protéines appelées amyloïde-β, et à leur accumulation dans le cerveau sous forme de plaques amyloïdes.
Dans des conditions normales, la maladie d'Alzheimer n'est pas contagieuse. Mais des travaux épidémiologiques ont suggéré que des dépôts d'amyloïde-β peuvent être transmis d'un patient à l'autre, chez l'humain, dans des circonstances exceptionnelles (injections d'hormones de croissance extraites/produites à partir de cerveau, procédures neurochirurgicales avec greffes de tissus d'origine cérébrale). Il est essentiel de comprendre quels sont les caractéristiques des cerveaux qui, dans ces circonstances exceptionnelles, sont capables d'induire une pathologie amyloïde chez un nouveau patient. Jusqu'à présent, l'hypothèse avancée était que les cerveaux présentant les lésions de la maladie sont responsables de l'induction de la pathologie. Précédemment, des chercheurs du Laboratoire des Maladies Neurodégénératives de MIRCen ont notamment montré que l'inoculation d'extraits de cerveaux humains atteints de la maladie d'Alzheimer dans des cerveaux de modèles primates induit la formation de plaques amyloïdes et provoque des troubles de la mémoire et une maladie caractérisée par une perte de neurones, une altération de leur capacité à communiquer entre eux, ainsi qu'une réduction de la taille du cerveau. Il s'agissait alors de la première démonstration de l'induction de signes cliniques associés à un processus neurodégénératif par inoculation d'extraits de cerveaux humains affectés par la maladie d'Alzheimer.
Dans une étude publiée dans la revue Acta Neuropathologica Communications, des chercheurs du même laboratoire démontrent maintenant que l'inoculation d'échantillons de cerveaux en apparence sains peuvent induire l'apparition d'amyloïde-β. Cela suggère que les éléments transmissibles invisibles avec les techniques d'analyses classiques y sont bien présents. Pour arriver à cette conclusion, des homogénats de cerveaux humains affectés par la maladie d'Alzheimer ont été inoculés à un modèle murin résistant aux dépôts d'amyloïde-β. Plus de 18 mois après l'inoculation, les animaux n'ont pas développé de lésion dans l'hippocampe : leur cerveau ne présente pas de lésion amyloïde-β visible, alors qu'il a pourtant été en contact avec des dépôts amyloïdes. Un homogénat issu de ces hippocampes, apparemment sains, a ensuite été injecté à un second modèle plus apte à développer des lésions amyloïde-β, et dans lequel des plaques amyloïdes ont effectivement été observées. Cela suggère que des « graines » d'amyloïde-β, issues d'échantillons de cerveaux humains, peuvent persister sous des formes furtives dans les tissus cérébraux tout en conservant leur capacité à favoriser les dépôts d'amyloïde-β chez des hôtes réceptifs.
Ces travaux soulignent la nécessité de mesures préventives de haut niveau, notamment dans le contexte de la neurochirurgie, pour prévenir le risque de transmission de l'amyloïde-β à partir d'échantillons de tissu cérébral potentiellement atteint, même apparemment sain. Dans le contexte des chirurgies cérébrales chez l'humain, de nombreuses mesures de protection ont été mises en place ces dernières années et le risque de transmission d'amyloïde-β est faible voire inexistant.
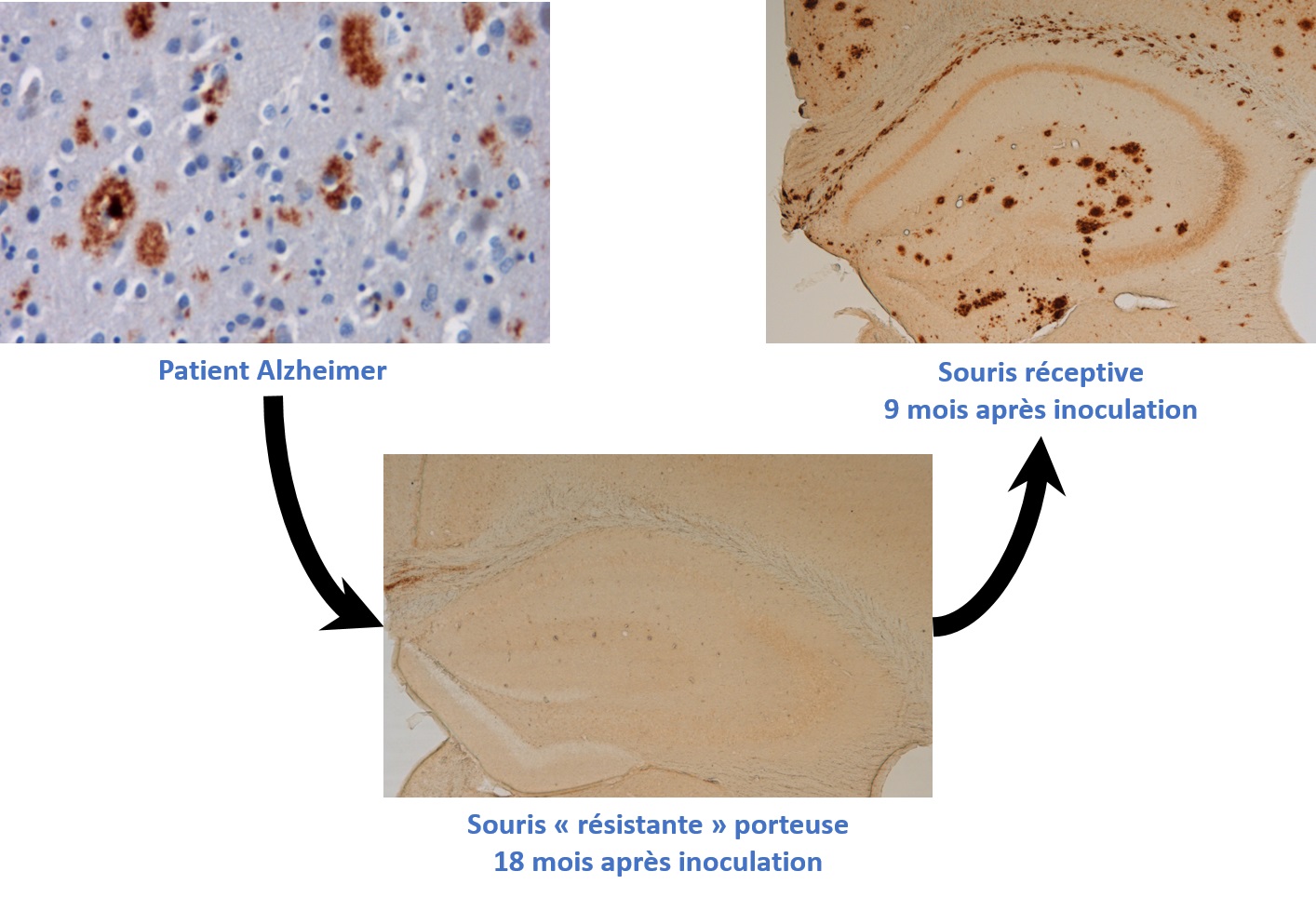
Inoculation
séquentielle d'extraits de : cerveau humain atteint de la maladie d’Alzheimer et
présentant des plaques amyloïdes (en haut à gauche) chez un animal inapte au
développement de ces lésions (en bas) ; cerveau murin contenant des traces
invisibles issues de l’inoculation de cerveau Alzheimer (en bas) chez un animal
apte à développer ces lésions (en haut à droite) induisant le développement de
plaques amyloïdes semblables à celles observées chez l’Homme.
* l’hippocampe est une structure
cérébrale essentielle pour la mémoire.
En savoir plus sur les travaux de l’équipe