En cas d'attaque de l'organisme par un agent pathogène, le système immunitaire mobilise ses mécanismes de défense, grâce à l'action coordonnée et adaptée de son armée de cellules spécialisées. Cette coordination, essentielle, est permise par l'échange de signaux entre cellules par contacts intracellulaires directs, ou par l'intermédiaire de médiateurs solubles, les cytokines. L'interféron béta (IFN-β) est une de ces cytokines, qui régule la réponse immunitaire adaptative aux infections et aux tumeurs, notamment lors d'une radiothérapie. La production d'IFN-β est une étape essentielle dans la réponse antivirale, et une dérégulation de son expression est liée à la gravité des symptômes de la Covid-19.
Des chercheurs du Laboratoire de Réparation et Transcription dans les cellules Souches hématopoïétiques (IRCM / CEA-Jacob), en collaboration avec l'équipe de Génétique Évolutive Humaine (Institut Pasteur), se sont intéressés à la régulation de l'expression de l'IFN-β dans les cellules myéloïdes, des cellules du système immunitaire. Leurs travaux, publiés dans la revue PLoS Genetics, montrent que nous ne sommes pas égaux pour l'expression de l'IFN-β par nos cellules myéloïdes. À partir d'un modèle murin, les chercheurs ont identifié un élément « enhancer », une séquence d'ADN non codante* permettant de réguler à distance l'expression de l'IFN-β dans les cellules myéloïdes. Ils ont ensuite montré que cet enhancer est conservé chez l'Homme, et porteur d'un polymorphisme génétique : deux séquences, présentant une différence ponctuelle, coexistent dans la population pour une même position dans le gène. Alors que la majorité des gens sont porteurs d'une adénine (A) au centre de l'enhancer (allèle majeur), cette adénine est remplacée par une guanine (G) dans 30% des cas (allèle mineur). Cette substitution empêche la fixation du facteur de transcription C/EBP-β sur l'allèle mineur de l'enhancer, et diminue l'expression et donc la production de l'IFN-β par les cellules myéloïdes. Ces résultats mettent au jour le mécanisme moléculaire liant un polymorphisme localisé dans une région non-codante du génome et des caractéristiques cellulaires.
À l'heure actuelle, l'allèle mineur du polymorphisme n'a pas été identifié comme étant porteur d'un risque pour une pathologie humaine. Des travaux sont en cours pour étudier son importance dans des processus physiopathologiques décrits récemment et impliquant l'expression de l'IFN-β, comme la COVID-19 ou la réponse immunitaire anti-tumorale radio-induite.
Les résultats ont d'ailleurs fait l'objet d'un dépôt de brevet concernant l'utilisation de ce polymorphisme comme marqueur pronostic d'une réponse immunitaire anti-tumorale radio-induite. D'autre part, l'hypothèse d'un lien entre ce polymorphisme et la gravité des symptômes de la COVID-19 fait partie du projet COVIDOGEN piloté par le CNRGH (CEA-Jacob), et financé par l'Université Paris-Saclay dans le cadre de son projet de recherche exceptionnel COVID-19.
Pour en savoir plus sur le projet COVIDOGEN
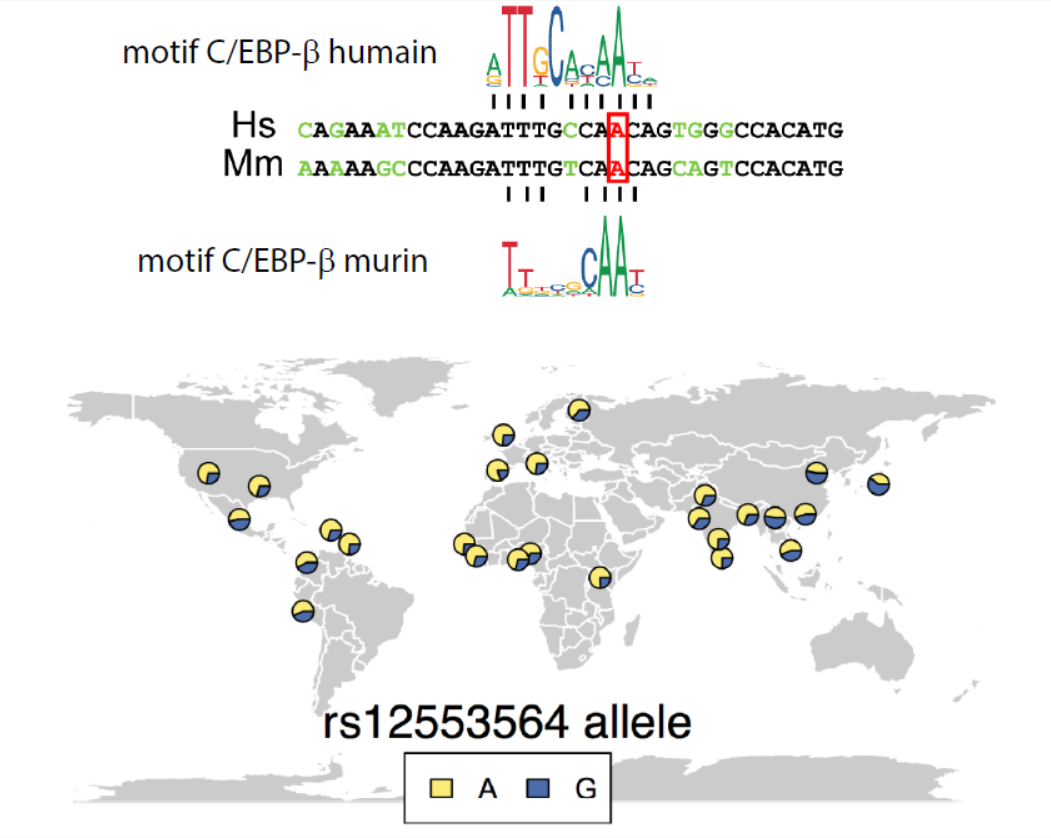
Haut : alignement des séquences ADN humaine et murine du site de liaison du facteur de transcription C/EBP-β. Bas : répartition géographique, en proportions, de la fréquence des allèles contenant un A (en jaune) ou un G (en bleu) dans les populations. (tiré de l'article © G. Rousselet)
* une séquence d'ADN non codante est un fragment d'ADN dont la séquence n'est pas traduite en protéine.