La microscopie optique super-résolution, ou « nanoscopie », a révolutionné l’imagerie du vivant, grâce au marquage des molécules à imager avec des protéines fluorescentes dites « photo-commutables ». Ces minuscules interrupteurs moléculaires passent réversiblement d’un état fluorescent (on) à un état éteint (off) après excitation par un flash lumineux (on parle de photo-commutation). Pour les concevoir sur mesure, il est nécessaire de comprendre leurs mécanismes de photo-commutation, qui impliquent des états transitoires ultra-rapides.
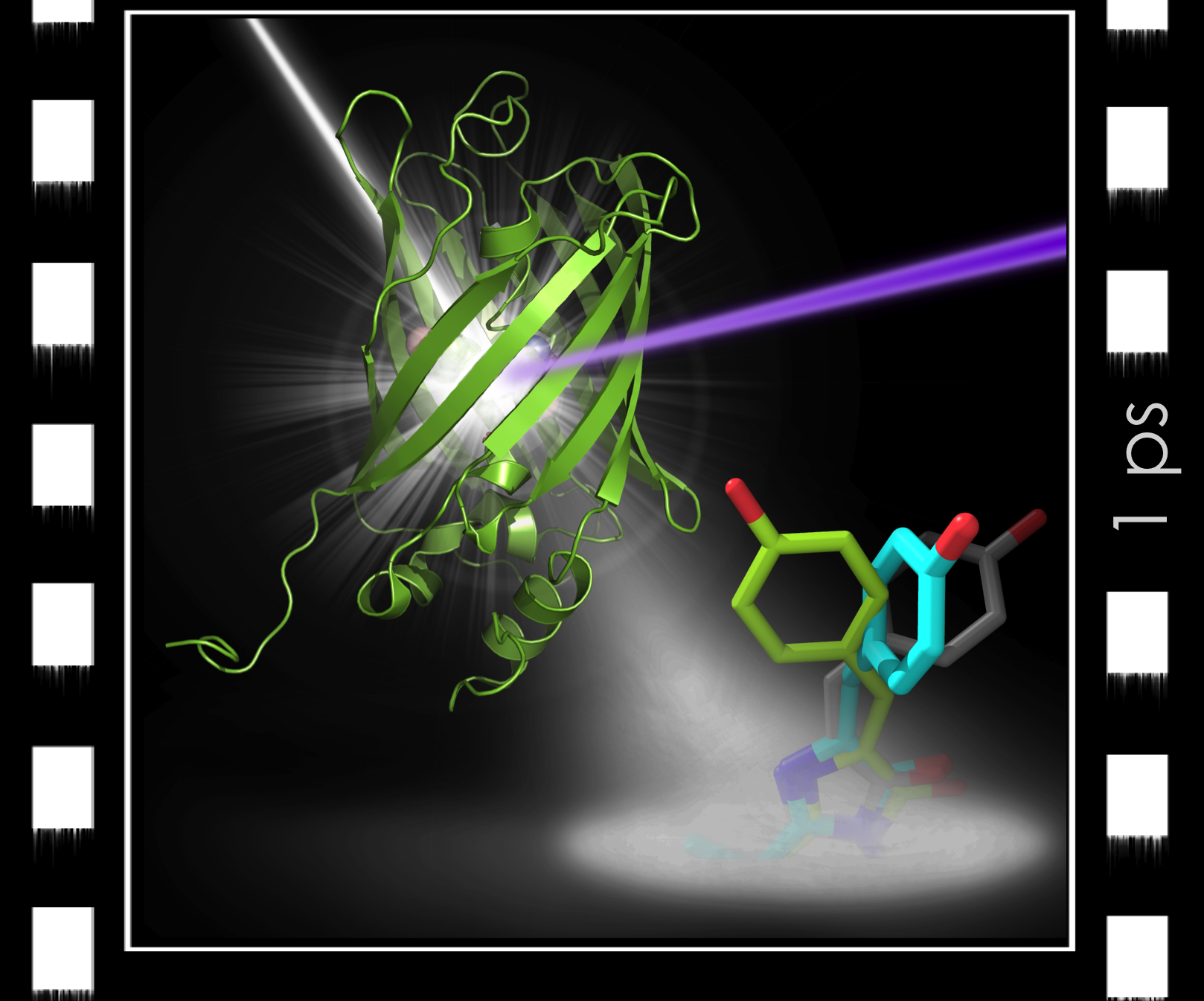
Cinéma ultra-rapide d’une protéine en action. La protéine fluorescente (verte) est excitée par un laser de lumière visible (rayon violet) et impactée par une impulsion de rayons X (rayon blanc) produite par un laser X à électrons libres. Une picoseconde après excitation, le chromophore (bleu) au cœur de la protéine est observé à mi-chemin entre les deux formes stables (‘off’ en gris, ‘on’ en vert) ; sa vitesse de déplacement (4,6 Angströms en 1 picoseconde) correspond à celle d’un avion supersonique (460 m / s) !
© Virgile Adam / IBS
Pour la première fois, les scientifiques ont pu filmer la commutation en temps réel d'une protéine fluorescente en utilisant une toute nouvelle génération de source de rayons X, les lasers à électrons libres (XFEL, pour X-ray free electron laser). Ces dispositifs produisent des impulsions de rayons X très courtes de l’ordre de la femtoseconde (un millionième de milliardième de seconde) et très intenses au cœur d'une installation longue de plusieurs kilomètres.
- Le CEA, le CNRS, et l’Université Grenoble-Alpes collaborent notamment au sein de l’Institut de biologie structurale (IBS).
Au centre de l'accélérateur linéaire de Stanford (SLAC Linear Accelerator Center), les auteurs de l’étude ont fait coïncider un flux de minuscules cristaux de la protéine fluorescente avec les impulsions de rayons X, collectant ainsi une myriade de clichés de diffraction. Étant donné l’extrême intensité du faisceau de rayons X, chaque cristal impacté explose immédiatement après que l’information de diffraction a été collectée – d’où la nécessité de constamment renouveler l’échantillon dans cette technique dite de « cristallographie sérielle ». Pour observer des états intermédiaires entre les deux états statiques on et off, la réaction photochimique est provoquée dans la protéine par un flash laser lumineux déclenché à peine une picoseconde (un millième de milliardième de seconde) avant l’impact d’une impulsion de rayons X.
C’est ainsi que les auteurs ont pu déterminer la structure transitoire de la protéine fluorescente dans son état excité, et observer le chromophore – la partie de la protéine qui absorbe la lumière – dans un état tordu (« twisté »), à mi-chemin entre les conformations stables des états on et off (cf. figure). Cette observation, confirmée par des simulations, a permis aux chercheurs d’émettre des hypothèses sur le mécanisme de photo-commutation de la protéine. Ces hypothèses ont ensuite pu être vérifiées grâce à la mutagénèse dirigée.
Jusqu’à présent, seuls deux lasers X à électrons libres étaient opérationnels au monde : celui qui a été utilisé pour cette étude à Stanford, dans la Silicon Valley aux Etats-Unis (instrument LCLS du SLAC National Accelerator Laboratory), et l’autre au Japon, dans la province d’Osaka (SACLA). Le premier laser à électrons libres européen, auquel la France a contribué, a été inauguré le 1er septembre à Hambourg (Allemagne) et l’une des premières expériences prévues sera menée par le consortium auteur de cette étude. Il promet un avenir radieux au cinéma moléculaire.

Installation du SLAC National Accelerator Laboratory, basée aux États-Unis. Les chercheurs ont utilisé ce laser X long de plusieurs kilomètres pour « filmer » les changements conformationnels internes d’une protéine, soit des mouvements de quelques Angströms (10-10 mètres) qui se déroulent en quelques millièmes de milliardièmes de seconde. © SLAC National Accelerator Laboratory © SLAC National Accelerator Laboratory