De très nombreuses fonctions cellulaires fondamentales sont réalisées par des assemblages protéiques de grande taille. Cela concerne en particulier le contrôle qualité des protéines, processus par lequel les cellules assurent le recyclage ou le bon repli de leurs principaux constituants, afin d’éviter l’accumulation de protéines mal repliées, agrégats ou fibrilles. Ces grandes machineries - chaperones, protéases et peptidases - sont complexes et dynamiques. Les études des telles machines biologiques présentent un défi pratique considérable, du fait de la taille même de ces particules, de la complexité de leurs substrats biologiques et des réarrangements structuraux impliqués.
Les chercheurs de l’IBS ont mis en place une approche reposant sur un marquage isotopique des groupements méthyle dans les protéines pour observer en solution par RMN des assemblages de très haut poids moléculaire. Cette méthode a été utilisée pour l’étude structurale et fonctionnelle d’une chaperonine de 1 MDa activée par l’ATP, durant le repliement de sa protéine cliente. Ils ont ainsi pu sonder les événements de liaison et d’hydrolyse de l’ATP, les liaisons transitoires des protéines non repliées et les réarrangements structuraux dans cette grande machinerie biologique en action. Les résultats, publiés dans
Sciences Advances le 19 septembre 2018, révèlent le mode de régulation du cycle fonctionnel de cet assemblage complexe. Ces nouvelles technologies ouvrent de nouvelles pour étudier directement les structures et les mécanismes de diverses machines biologiques pendant qu’elles exécutent leurs fonctions physiologiques. Elles ont été implémentées sur les plates-formes de marquage isotopique et de RMN haut champ de l’ISBG, toutes les deux accessibles aux chercheurs nationaux et européen grâce au soutien de l’IR-RMN, FRISBI, Instruct-ERIC et iNext. (Détails).
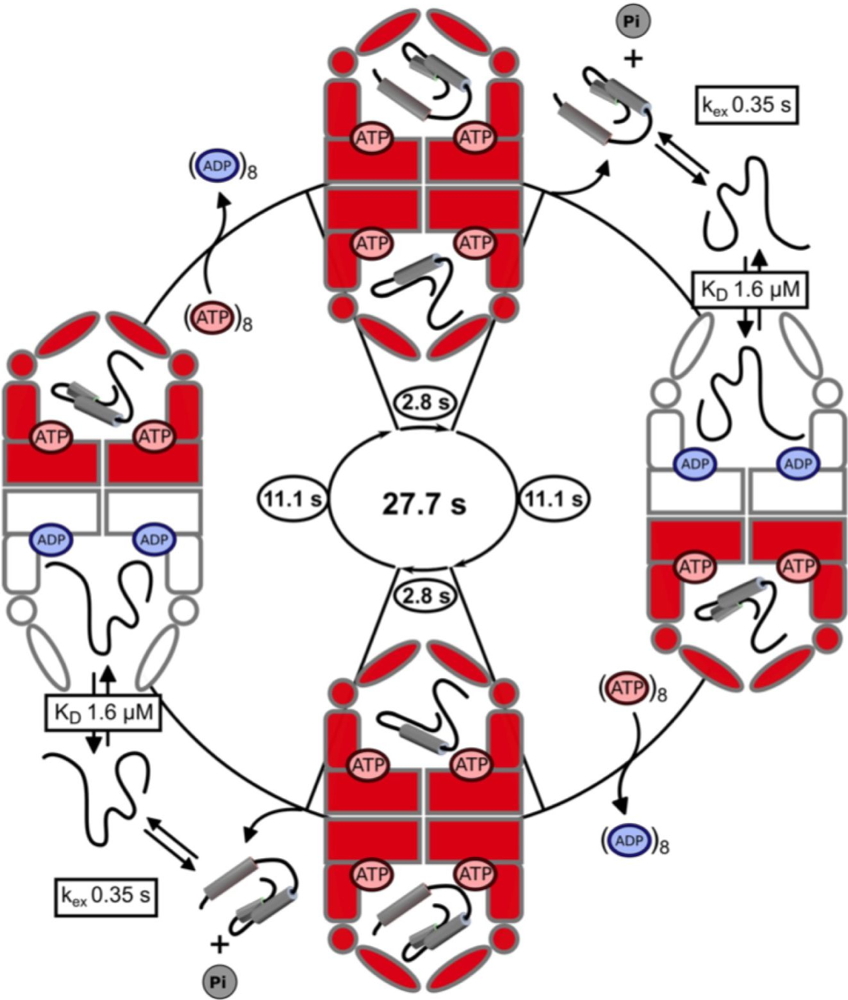 Cycle fonctionnel de la chaperonine hsp60 en action déterminé par l’étude RMN. La protéine cliente dépliée est stabilisée par son interaction avec la partie basale de la cavité de la chaperonine ouverte et chargée d'ADP. Les sites de liaison aux nucléotides, initialement occupés par l'ADP, se lient à l'ATP. La liaison de l'ATP, plutôt que son hydrolyse, ferme l'anneau qui reste fermé jusqu'à l'hydrolyse de l'ATP. Après l'hydrolyse, l’anneau de la chaperonine s’ouvre à nouveau mais l'ADP reste lié, empêchant la recharge immédiate d’ATP et la fermeture de la chaperonine. Les anneaux de chaperonine sont représentés par deux monomères symétriques colorés en blanc (cycle inactif : ADP lié et ouvert) ou rouge (cycle actif : ATP lié et fermé). La durée de chaque étape du cycle fonctionnel est calculée à partir du taux global d'hydrolyse de l'ATP et des populations relatives de l'état ouvert / fermé, déterminés par RMN.
Cycle fonctionnel de la chaperonine hsp60 en action déterminé par l’étude RMN. La protéine cliente dépliée est stabilisée par son interaction avec la partie basale de la cavité de la chaperonine ouverte et chargée d'ADP. Les sites de liaison aux nucléotides, initialement occupés par l'ADP, se lient à l'ATP. La liaison de l'ATP, plutôt que son hydrolyse, ferme l'anneau qui reste fermé jusqu'à l'hydrolyse de l'ATP. Après l'hydrolyse, l’anneau de la chaperonine s’ouvre à nouveau mais l'ADP reste lié, empêchant la recharge immédiate d’ATP et la fermeture de la chaperonine. Les anneaux de chaperonine sont représentés par deux monomères symétriques colorés en blanc (cycle inactif : ADP lié et ouvert) ou rouge (cycle actif : ATP lié et fermé). La durée de chaque étape du cycle fonctionnel est calculée à partir du taux global d'hydrolyse de l'ATP et des populations relatives de l'état ouvert / fermé, déterminés par RMN.