Certaines bactéries sont capables de fixer l'azote atmosphérique et de le transformer en ammoniaque à température ambiante, une réaction d’une importance capitale pour les plantes (cycle de l’azote). L’enzyme responsable de cette réduction est la nitrogénase, une métalloprotéine qui utilise deux centres métalliques : le P-cluster et le FeMo-co. Le premier est un centre atypique [Fe
8S
7] qui permet le transfert d’électron vers le FeMo-co. Ce dernier est le site actif proprement dit et correspond à un centre organométallique [MoFe
7S
9C-(R)-homocitrate]. Alors que le mécanisme réactionnel de la nitrogénase fait toujours l’objet d’âpres débats, les processus responsables de la production et l’insertion du FeMo-co dans l’enzyme sont loin d’être décryptés et sont également sources d’intenses controverses.
La biosynthèse du FeMo-co nécessite l’action d’une douzaine de protéines accessoires regroupées dans la machinerie d’assemblage NIF (
NItrogen Fixation). La protéine NifB est l’enzyme clé de ce processus car elle est responsable de la fusion de deux centres [Fe
4S
4] et de l’insertion d’un ion carbure et d’un ion sulfure pour produire un précurseur [Fe
8S
9C] appelé NifB-co. Des chercheurs de l’Irig étudient les mécanismes catalytiques de métalloenzymes contenant des métaux de transition, mais aussi les mécanismes de synthèse et d’insertion de ces sites métalliques dans les enzymes au sein desquels ils doivent être insérés. En 2020, en collaboration avec l’Universidad Politécnica de Madrid, ils ont publié la première structure cristalline de la protéine NifB, représentant un état précoce de la réaction de synthèse du NifB-co. Ces travaux ont été rapidement suivis par une autre publication d’une équipe de chercheurs américains rapportant une structure cristalline avec l’ensemble des centres métalliques présents. Malheureusement, cette équipe a mal modélisé leurs données cristallographiques et a de ce fait été dans l’incapacité d’identifier correctement le contenu du site actif.
En reprenant ces données cristallographiques, les chercheurs de l’Irig ont pu mettre en évidence la présence inattendue d’un centre [Fe
8S
8] résultant de la fusion des centres [Fe
4S
4]. Cette structure cristalline permet de ce fait de redéfinir l’ordre des réactions montrant que la fusion des centres FeS doit avoir lieu avant l’insertion de l’ion carbure. La coordination particulière de cet intermédiaire montre clairement le rôle de la matrice protéique dans l’organisation des étapes de biosynthèse du NifB-co, dévoilant ainsi le mécanisme de l’enzyme.
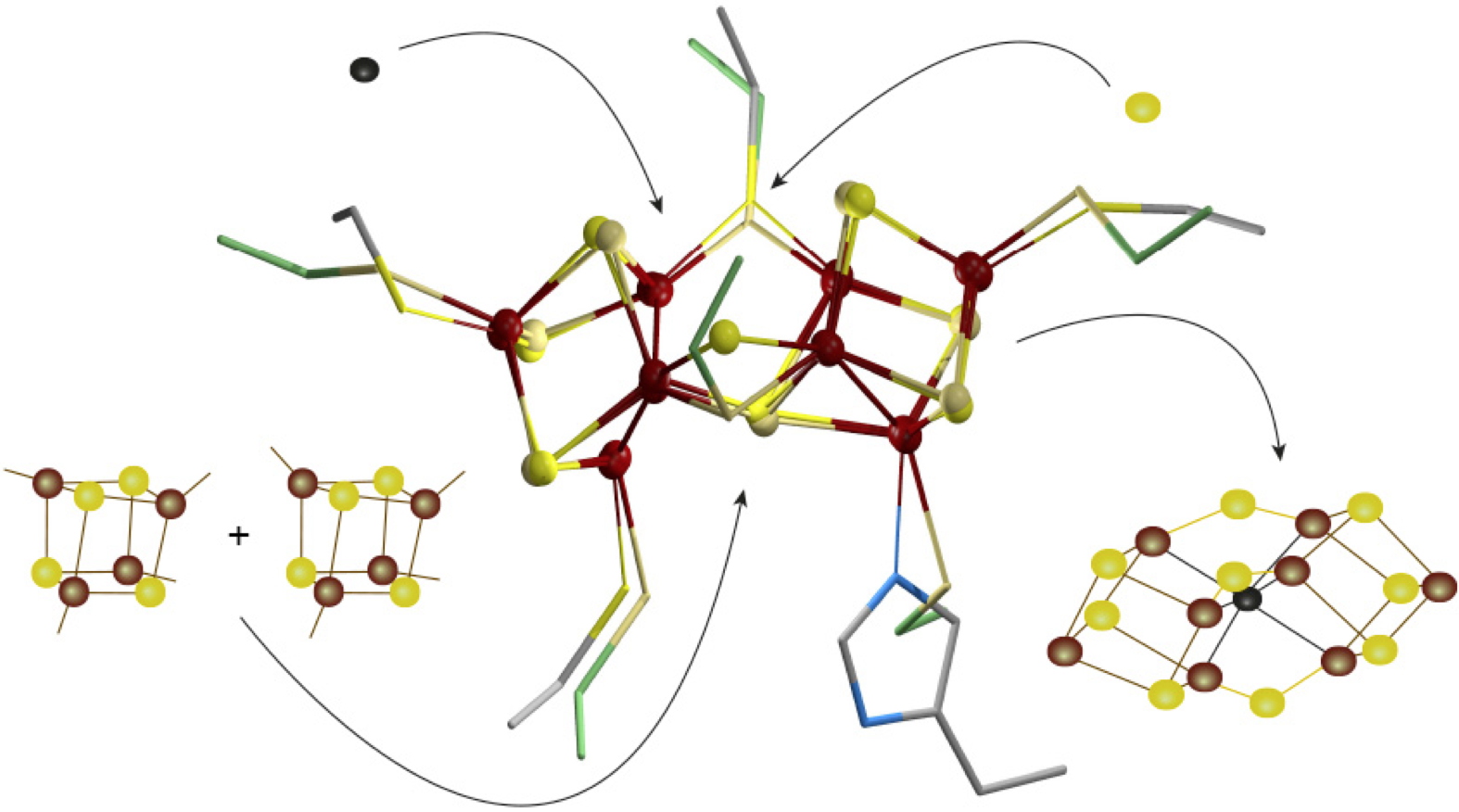
Le K-cluster : un nouvel intermédiaire dans la synthèse du NifB-co, avec une structure tridimensionnelle et une coordination similaires au P-cluster. Vision schématique des différents événements permettant la fusion de deux centres [Fe
4S
4] (à gauche) conduisant au K-cluster (au centre et superposé à la structure cristalline du P-cluster de la nitrogénase), puis l’arrivée de l’ion carbure et de l’ion sulfure afin de produire le NifB-co (à droite).