La quête de la neutralité carbone nécessite le développement de technologies pour la transformation du CO
2 et de ses dérivés en produits de commodité à partir d’énergie bas-carbone. Dans ce contexte, la conception de nouveaux procédés catalytiques efficaces et respectueux de l’environnement pour la réduction du CO
2 est au cœur des préoccupations sociétales. Dans le domaine de la catalyse à des fins de chimie durable, les
biocatalyseurs présentent l’intérêt d’être hautement sélectifs et efficaces en conditions douces (température et pression ambiantes, solvants aqueux). Cependant, malgré leurs avantages indéniables, le coût de production à grande échelle d’enzymes et leur manque de stabilité limitent encore le développement de telles approches.
Ceci est d’autant plus vrai pour les métalloenzymes rédox complexes, à l'image de la Monoxyde de carbone déshydrogénase (CODH), qui reste à ce jour le catalyseur le plus efficace pour activer des petites molécules comme le CO et le CO
2. La CODH comporte un site actif qui est remarquable en biologie, car composé d’un centre multi-métallique NiFe
4S
4 dont la biosynthèse comporte plusieurs étapes, ce qui nécessite une machinerie multi-protéique spécifique dont le fonctionnement est encore mal connu. Au cours des dernières années, des chercheurs de l’Irig ont étudié en détails les
protéines chaperons impliquées dans ce mécanisme. Ces études leur ont permis de mettre au point un système de production hétérologue de la CODH dans lequel le gène de la bactérie carboxydotrophe
Rhodospirillum rubrum (capable d'utiliser le CO comme source de carbone et d’énergie) est exprimée dans la bactérie
Escherichia coli. Ce procédé permet de produire une enzyme aussi stable et active qu’une CODH naturelle en une seule étape de purification. Les chercheurs sont allés plus loin en immobilisant cette CODH recombinante sur des nanotubes de carbone fonctionnalisés [collaboration avec le DCM-BEA de l’UGA Grenoble], ce qui leur a permis de développer un système bio-électro-catalytique stable pendant plusieurs heures pour aboutir à l’inter-conversion de CO
2 en CO (
Figure), atteignant des densités de courant de 4,2 mA.cm
-2 pour la réduction du CO
2 et 1,5 mA.cm
-2 pour l’oxydation du CO.
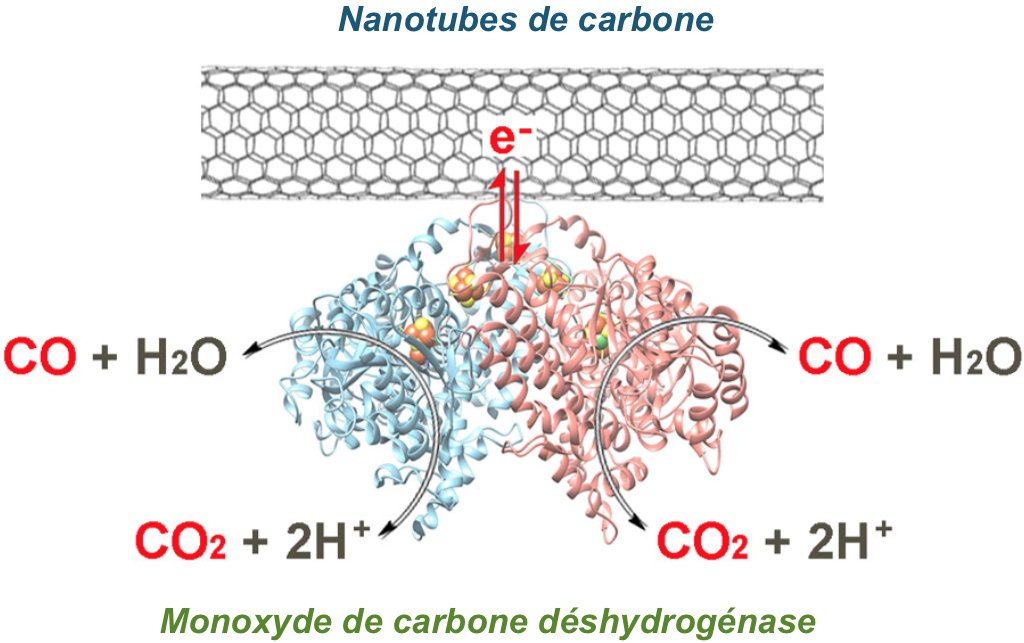
Inter-conversion de CO2 en CO catalysée par la Monoxyde de carbone déshydrogénase greffée sur des nanotubes de carbone.
© LCBM
En comparaison avec les procédés électrochimiques de réduction du CO
2 existants à base de catalyseurs moléculaires, ce procédé enzymatique atteint des performances similaires tout en apportant les avantages de fonctionner de façon réversible, en conditions douces et avec de très faibles surtensions. Ces résultats permettent d’envisager leur utilisation aussi bien pour la réduction du CO
2 que pour l’oxydation du CO, dans le cadre de procédés de purification de gaz de synthèse en vue de la production de divers produits chimiques ou carburants.
La Biocatalyse est l'utilisation de catalyseurs naturels, comme des enzymes, dans une réaction de synthèse organique.
Une protéine chaperon est une protéine dont la fonction est d'assister d'autres protéines dans leur maturation.