Les héparanes sulfate sont des
polysaccharides complexes appartenant à la famille des
glycosaminoglycanes (GAG), présents en abondance à la surface cellulaire et dans les
matrices extracellulaires. Ils se présentent branchés sur des glycoprotéines qui décorent la surface des cellules et sont impliqués dans de nombreux processus physiologiques et pathologiques. Leur structure et leur capacité à fixer et à moduler l'activité d'un très grand nombre de protéines sont finement contrôlés, notamment par des enzymes telles que l’endosulfatase HSulf-2, sécrétée dans le milieu extra-cellulaire, qui catalyse une désulfatation ciblée du polysaccharide. La compréhension des mécanismes mis en jeu dans ces régulations représente un enjeu évident pour l'étude de nombreuses fonctions cellulaires.
Les endosulfatases demeurent cependant des enzymes extrêmement énigmatiques. Ainsi, leur structure moléculaire, les mécanismes catalytiques et leur spécificité de substrat sont encore très peu documentés, et leur étude a conduit à une abondance de données contradictoires (divergences entre les données
in vitro et
in vivo en fonction du système biologique, isoformes d'enzymes présentant des activités anti-oncogéniques ou pro-oncogéniques…).
HSulf-2 est l’une de ces enzymes. Elle est étudiée par des chercheurs de l’Irig qui viennent de montrer que HSulf-2 est elle-même porteuse d’une chaîne de GAG. Ils ont analysé l'effet de cette chaîne dans divers essais
in vitro, cellulaires, ainsi que dans un modèle
in vivo de xénogreffe de cancer chez la souris. En utilisant un mutant de HSulf-2 dépourvu de sa chaîne GAG, les chercheurs ont montré un accroissement significatif de l’activité de l’enzyme
in vitro. L’expression de ce mutant dans des cellules de cancer mammaire favorise la prolifération, la migration et l’invasion cellulaire
in vitro, mais également la croissance tumorale et l’apparition de métastases pulmonaires dans un modèle
in vivo (
Figure. Credit CEA). Ils ont par ailleurs montré qu'une famille de glycosidases, les hyaluronidases, pouvait libérer l'enzyme de sa chaîne de GAG et restaurer son activité.
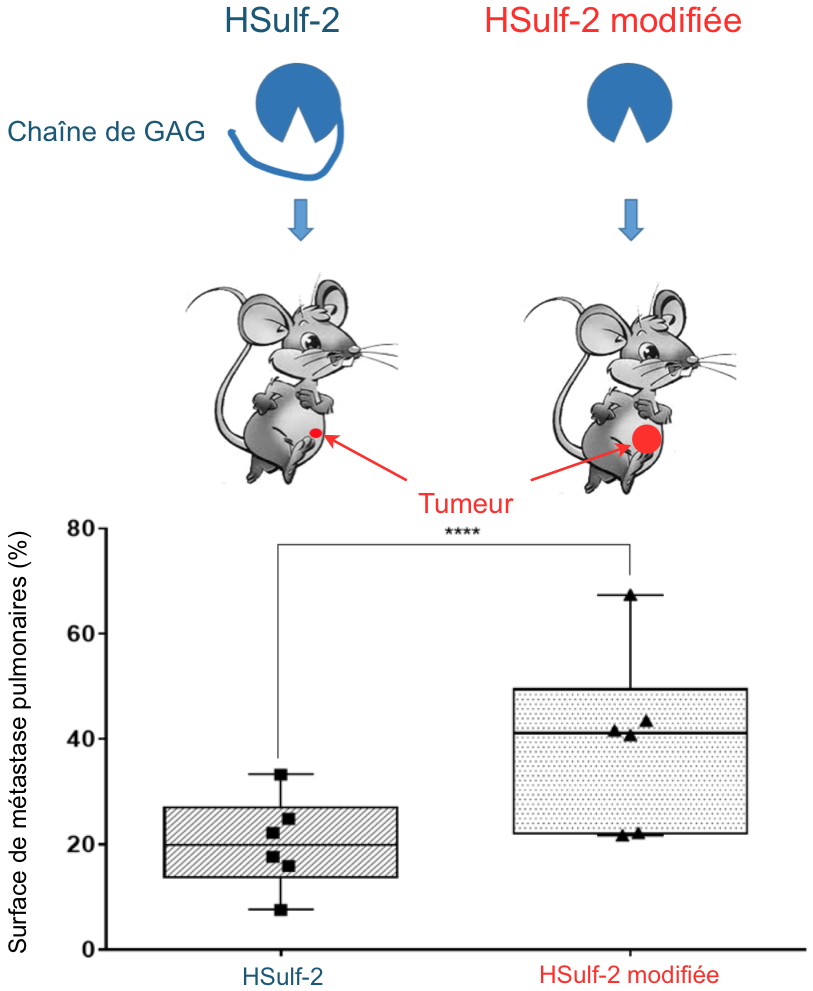
Ces données mettent clairement en évidence que la chaîne GAG de HSulf-2 agit comme un modulateur de l'activité pro-tumorale de l’enzyme, et que le degré de « GAGosylation » de HSulf-2 est un facteur important à prendre en compte pour étudier le rôle de l'enzyme dans le remodelage de la matrice extracellulaire. Cette découverte met en lumière un processus de régulation original et pourrait contribuer à clarifier près de deux décennies de données contradictoires dans l'étude des endosulfatases. Enfin, elle ouvre un nouveau champ d’investigation pour tenter de lutter contre le cancer primaire et métastatique en ciblant HSulf-2.
Les polysaccharides (parfois appelés glycanes ou glucides complexes) sont des polymères de la famille des glucides. Les plus répandus et connus dans le règne végétal sont la cellulose et l’amidon, tous deux polymères du glucose.
Les glycosaminoglycanes (GAG) sont des polysaccharides d’origine animale, trouvés en abondance à la surface des cellules et dans les matrices extracellulaires des tissus conjonctifs. La plupart des GAG se présentent sous la forme de longues chaînes linéaires sulfatées associées de manière covalente à des glycoprotéines particulières, et sont capables d’interagir et de moduler l’activité de centaines de ligands protéiques (protéines structurales, de signalisation, d’adhésion, enzymes…).
La matrice extracellulaire est un assemblage de macromolécules (collagènes, élastine et glycoprotéines de structure) qui lient des cellules et les organisent en tissus.