Les métaux de transition jouent un rôle primordial dans la fonction des protéines grâce à leurs propriétés particulières qui sont utilisées dans des processus catalytiques souvent inaccessibles pour des sites actifs qui ne renferment pas de métaux. Ainsi, les protéines dites à Radical SAM forment une superfamille de métalloenzymes qui utilisent un centre actif [4Fe-4S]
+ pour cliver la S-adénosyl-L-méthionine (SAM) afin de générer un radical 5′-désoxyadénosyl. Ce radical de haute énergie permet d’enrichir la panoplie de réactions chimiques possibles, conduisant à l’utilisation des enzymes à « Radical SAM » pour la biosynthèse de cofacteurs, la modification de peptides, ou encore la synthèse d’antibiotiques.
Du fait de leur potentiel, les métalloenzymes peuvent être considérées comme des outils biotechnologiques. Ainsi, des recherches sont menées dans le but de concevoir à terme de nouvelles métalloenzymes artificielles. Ces recherches portent en particulier sur la compréhension du mécanisme de contrôle par le squelette protéique des intermédiaires à haute énergie qui sont mis en jeu lors de la catalyse.
Les travaux menés par les chercheurs de l’Irig s’inscrivent dans ce contexte. Ces chercheurs ont étudié ThiH et NosL, deux protéines à radical SAM. Ces enzymes présentent une même structure primaire ainsi que des modes similaires de liaison avec leur substrat. La comparaison du mode de rupture de la liaison C-C du substrat permise par ces enzymes conduit à une meilleure compréhension des mécanismes mis en jeu. Ainsi, la structure cristalline de la protéine ThiH a montré un état de protonation inhabituel de son substrat, la L-tyrosine. Par ailleurs, la modélisation quantique des réactions a mis en évidence un
effet tunnel qui permet l’abaissement de la barrière d’activation de la réaction. Enfin, des changements structuraux subtils entre les deux enzymes affectent cette activation, conduisant à la différence de spécificité de la réaction et donc à des coupures de liaison C-C différentes.
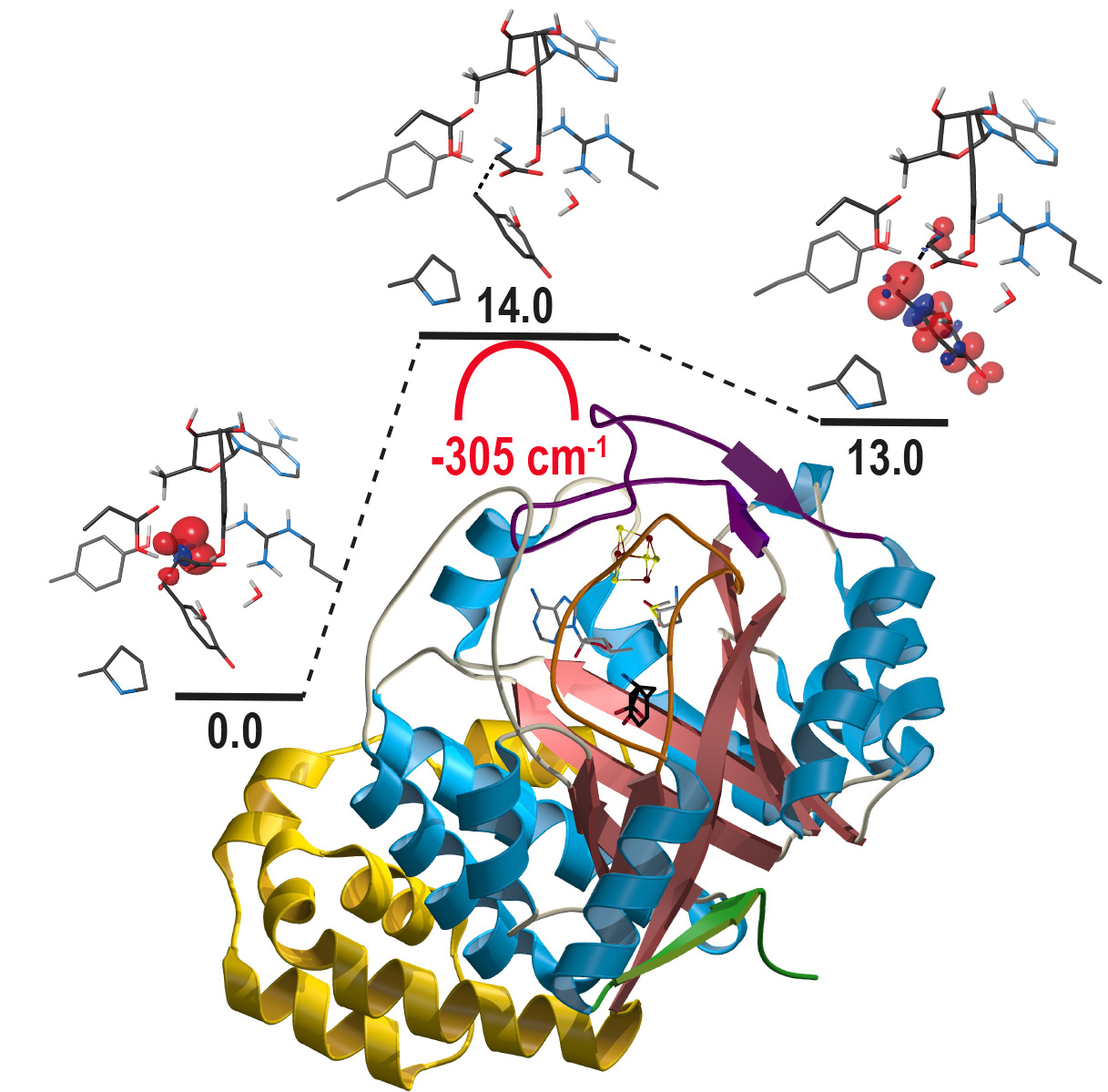
Structure de la protéine ThiH et modèles des intermédiaires de réaction. Credit CEA
Effet tunnel : phénomène quantique qui ne peut s’expliquer par la mécanique classique et qui permet le franchissement par un objet quantique d’une barrière de potentiel même si son énergie est inférieure à l’énergie minimale requise pour franchir cette barrière.