La majorité des cryptochromes est photosensible, leur permettant d’agir comme senseurs de lumière (bleue ou rouge). De plus, certains cryptochromes ont une fonction de photoenzymes leur permettant de réparer les dommages à l’ADN, tandis que d’autres sont les senseurs putatifs du champ magnétique terrestre chez les oiseaux migrateurs. Malgré leur ubiquité et leur exceptionnelle versatilité, le mécanisme qui gouverne les transitions entre les états de base, de signal, et l’état catalytiquement actif des cryptochromes est peu connu.
La collaboration étendue, menée par une équipe de l’Université Nationale de Taiwan (NTU) et comprenant des membres de l’Université d’Osaka (Japon), l’Université de Marbourg (Allemagne), l’Institut de Biologie Structurale (IBS, Grenoble) et l’European Synchrotron Radiation Facility (ESRF, Grenoble), a enregistré un film moléculaire des événements se produisant lors de la transmission du signal lumineux par le cryptochrome entre 10 nanosecondes et 233 millisecondes après l’illumination.
Pour ce faire, ils ont combiné les données structurales acquises par cristallographie sérielle femtoseconde résolue dans le temps (TR-SFX) au laser à électrons libres (XFEL) SACLA au Japon à des données de spectroscopie d’absorption de lumière UV-visible résolue dans le temps enregistrées in crystallo sur le nouvel instrument TR-icOS de la plateforme de spectroscopie optique icOS (opérée conjointement par l’ESRF et l’IBS).
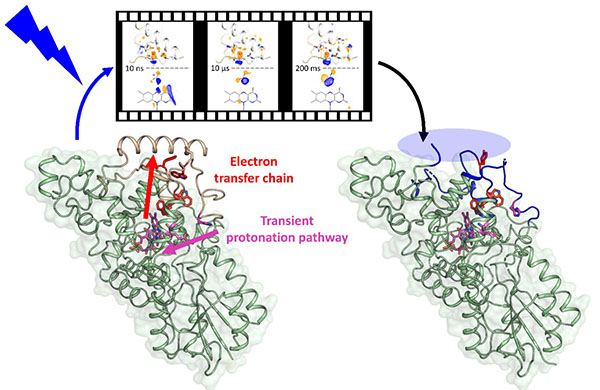
Les cryptochromes utilisent une molécule de flavine adénosine diphosphate (FAD) comme cofacteur sensible à la lumière. L’absorption d’un photon bleu par ce cofacteur déclenche une chaîne de transfert d’électrons ultrarapide. Le film moléculaire enregistré par ces chercheurs dévoile
les étapes structurales qui relient ces phénomènes ultrarapides aux larges réarrangements structuraux puis à la déstabilisation du domaine C-terminal observés dans la structure de l’état de signal du cryptochrome.
Le film révèle ainsi que l’étape de protonation de la FAD agit comme un seuil qui engage le cryptochrome sur le chemin de la déstabilisation du C-terminus et donc de l’état de signalisation. Une expérience de spectroscopie résolue en temps, réalisée sur le même type de cristaux que ceux de l’expérience de diffraction, a permis d’identifier précisément l’échelle de temps sur laquelle cette étape de protonation a lieu, révélant l’existence d’un chemin de protonation transitoire identifiable dans le film structural obtenu par TR-SFX. Ce chemin s’ouvre sur une échelle de temps bien plus longue (microsecondes) que la fin de la chaîne de transfert électronique (dizaine de nanosecondes), expliquant en partie le découplage temporel entre chaîne de transfert électronique et établissement de l’état de signalisation. Cette étape de protonation pourrait aussi jouer un rôle dans le mécanisme de magnétoréception par les cryptochromes, en affectant la paire de radicaux formée à la fin de la chaîne de transfert électronique.
Enfin, la description détaillée des événements structuraux menant à l’état de signalisation pourrait permettre de comprendre comment les cryptochromes passer d’une fonction à une autre.