Certaines de nos cellules disposent à leur surface d’appendices filiformes qui peuvent se mouvoir. C’est le cas dans nos bronches où le battement de nombreux cils permet l’écoulement du mucus, une barrière de protection naturellement présente dans notre organisme. D’autres cellules peuvent être munies d’un flagelle unique, comme les spermatozoïdes. Le flagelle, dont la structure est commune à celle du cil, se déforme lui aussi pour créer un mouvement ondulatoire, responsable de la « nage » du spermatozoïde.
FOCUS : le flagelle, un système couplant filaments et moteurs moléculaires
Un flagelle est constitué d’une structure de filaments parallèles — les microtubules. Des moteurs moléculaires, les dynéines, forment des liens entre les filaments. En se mettant sous tension, ils forcent les filaments à coulisser les uns par rapport aux autres. Ce mouvement, lorsqu’il est bien coordonné, créé des ondulations régulières et rythmées du flagelle. Depuis des décennies, les chercheurs visent à comprendre la manière dont les filaments et les moteurs moléculaires arrivent à s’auto-organiser pour créer ce mouvement régulier dans le temps et dans l’espace.
Un système d’étude innovant
À partir des travaux de l’équipe du CytomorphoLab au CEA de Grenoble, il est devenu possible de polymériser, c’est-à-dire de « construire », des filaments d’actine
[3] et de les organiser en réseaux d’architecture prédéfinie.
L’équipe « Mécano-sensibilité active des cellules ciliées de l’oreille interne » dirigée par Pascal Martin, directeur de recherche CNRS à l’Institut Curie, utilisait cette méthode d’assemblage de l’actine lorsqu’un phénomène
remarquable a été observé : «
Mathieu Richard, alors doctorant dans mon équipe sur un tout autre sujet, a assemblé des filaments d’actine dans un bain de myosines, dans le but de tester leur activité. De manière tout à fait inattendue, les filaments se sont rapprochés et ont formé spontanément des faisceaux ondulants comme des flagelles. », raconte le chercheur. C’est la première fois que l’on parvient à observer ce phénomène dans un système « artificiel » d’actine et de myosine.
Dans ce système, les chercheurs n’utilisent ni les microtubules ni les dynéines des flagelles, mais un autre type de filament, l’actine, et un autre moteur moléculaire, la myosine. Cependant, le fait de retrouver un mouvement ondulatoire tout à fait semblable à celui d’un flagelle suggère que
des lois physiques communes peuvent s’appliquer à ces différents systèmes de filaments et de moteurs moléculaires.
Une autre observation surprenante a permis d’éclairer le mécanisme des ondulations. Marie Pochitaloff, durant son doctorat dans l’équipe de Pascal Martin, a visualisé la répartition de la myosine le long des faisceaux de filaments. Pascal Martin nous explique : «
Nous nous attendions à trouver la plupart de la myosine à la base des faisceaux car c’est à cet endroit que l’on trouvait le plus de filaments, et donc le plus de sites de liaisons potentiels. Contre toute attente, nous avons observé que la myosine se fixait à un endroit où il y a moins de filaments mais où la courbure de la structure était la plus extrême, avant de se déplacer vers l’extrémité du faisceau. »
Ce couplage entre l’onde de courbure et la localisation des moteurs révèle une relation étroite entre la courbure des faisceaux de filaments et leur liaison aux moteurs moléculaire.
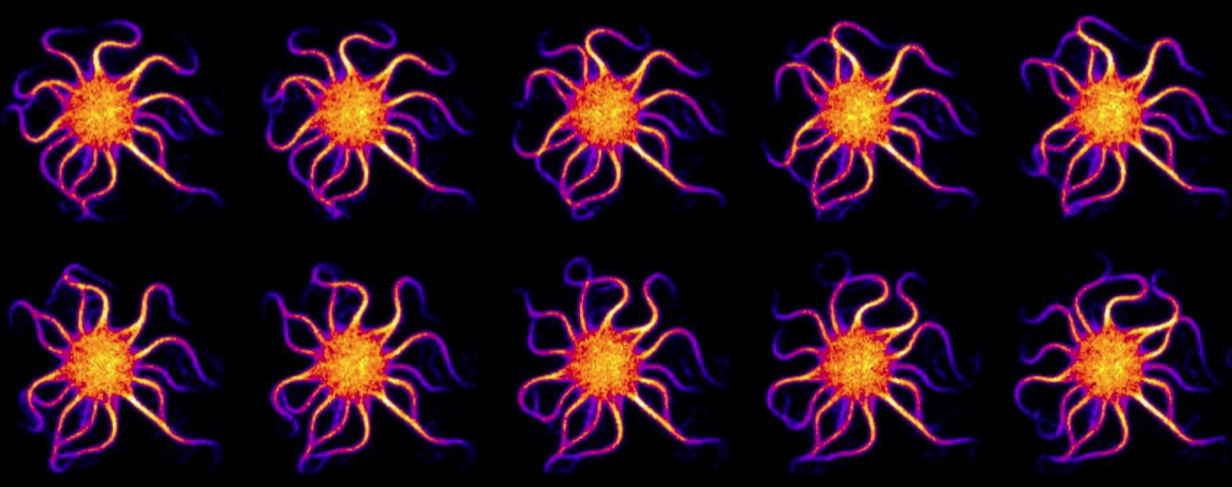
Suivi de l’ondulation des faisceaux d’actine sur une période.
© Pascal Martin/Institut Curie
Entre biologie expérimentale et physique théorique
Grâce au travail de physique théorique de Martin Miranda, dans son doctorat codirigé par le
Pr Frank Jülicher au Max Planck Institute for the Physics of Complex Systems et par Jean-François Joanny, Professeur au Collège de France, il a été possible de
modéliser quantitativement les observations expérimentales pour comprendre l’origine physique de l’ondulation spontanée. «
C’est cette collaboration entre expérience et théorie, entre biologie et physique, qui a rendu ces résultats possibles. » ajoute Pascal Martin.
Cette nouvelle approche permettra donc d’étudier, aussi bien expérimentalement que théoriquement, les phénomènes complexes impliqués dans l’auto-organisation des systèmes de filaments et de moteurs moléculaires. Il a déjà permis de montrer une corrélation entre la courbure des faisceaux de filaments et leur liaison aux moteurs moléculaires ainsi que l’existence de lois physiques générales dans ces systèmes. Les études futures viseront à élucider les mécanismes moléculaires permettant aux moteurs de ressentir la courbure des filaments et comment il est possible de réguler cette mécano- sensibilité.
Il s’agit d’un premier pas vers une meilleure compréhension du fonctionnement et dysfonctionnement des cils et flagelles et, au-delà, d’autres processus biologiques associées à des déformations du cytosquelette par des moteurs moléculaires.
[1] Les travaux ont été menés dans
-
le Laboratoire physico-chimie Curie (UMR 168 - Institut Curie, CNRS, Sorbonne Université) par l’équipe « Mécano-sensibilité active des cellules ciliées de l’oreille interne » dirigée par Pascal Martin,
-
au Max Planck Institute for the Physics of Complex Systems (Dresde, Allemagne) par l'équipe du Pr Franck Jülicher, en collaboration avec le Pr Jean-François Joanny (Institut Curie/Collège de France),
-
au Laboratoire physiologie cellulaire & végétale dans l’équipe CytomorphoLab co-dirigée par Laurent Blanchoin et Manuel Théry (CNRS, CEA, UGA, INRAE).
[2] Le flagelle artificiel créé ici résulte de l’assemblage d’un grand nombre (plusieurs milliers) de molécules individuelles.
[3] Les filaments d’actine, comme les microtubules, sont un des composants essentiels du cytosquelette, permettant à la cellule d’adopter diverses formes et de se mouvoir sous l’action de moteurs moléculaires.