Aujourd’hui, il est essentiel de concevoir de nouveaux catalyseurs à la fois performants et respectueux de l’environnement comme alternatives à certains procédés industriels. À titre d’exemple, la réaction du gaz à l’eau (Water-Gas Shift Reaction WGSR : CO + H2O ↔ CO2 + H2) utilise des catalyseurs industriels fonctionnant à hautes pression et température. Cette réaction, qui permet d’enrichir les gaz de synthèse issus de la pétrochimie en H2 pour la synthèse de carburants liquides, est présente naturellement chez certaines bactéries. Dans ces organismes, la réaction est catalysée par deux enzymes : la CO déshydrogénase (CODH) et une hydrogénase. Ainsi, l'objectif des chercheurs du
CEA-Irig/LCBM est de développer des dispositifs enzymatiques efficaces et innovants.
Les gaz de synthèse ou syngaz, composés majoritairement de H2, CO et CO2 présentent un intérêt majeur pour la synthèse de carburants liquides et de molécules chimiques, en servant d’intermédiaires polyvalents dans des procédés tels que la synthèse de Fischer-Tropsch, où le ratio H2/CO joue un rôle crucial dans l'efficacité et la sélectivité des réactions. La réaction du gaz à l’eau (Water-Gas Shift Reaction, WGSR) permet d’ajuster ce ratio en convertissant du CO et de l’eau en CO2 et H2, optimisant ainsi la composition du syngaz selon les besoins du procédé. Par exemple, la synthèse de méthanol requiert un ratio 1CO/2H2, alors que le ratio typique dans les gaz de synthèse est d’environ 0.3. La réaction WGSR (CO +H2O ↔ CO2 + H2) est catalysée en deux étapes : l’oxydation du CO (CO + H2O -> CO2 + 2e- + 2H+) et la réduction des protons en H2 (2e- + 2H -> H2).
L’objectif de ce travail était de concevoir un système bicatalytique associant une enzyme et un complexe moléculaire : une monoxyde de carbone déshydrogénase (CODH) capable d’oxyder le CO en CO2, couplée à un catalyseur bio-inspiré à base de nickel, efficace pour la réduction des protons en H2. La CODH a d’abord été caractérisée à l’échelle moléculaire, puis intégrée dans un système bio-hybride où les deux catalyseurs sont immobilisés sur des nanotubes de carbone. Ces derniers jouent un rôle crucial en facilitant le transfert d’électrons entre les deux catalyseurs, ce qui accélère la conversion du CO en CO2 et la production simultanée d’hydrogène (voir
figure).
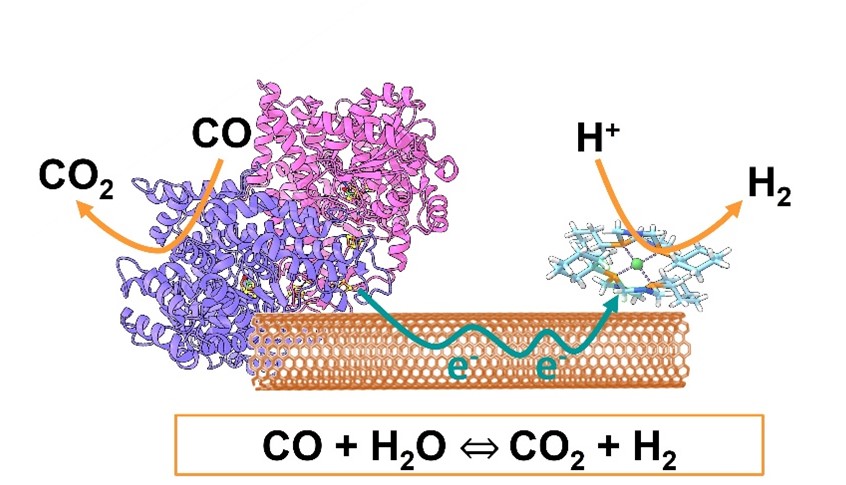
Figure : Dispositif bio-hybride pour la réaction WSGR couplant une enzyme, un complexe bio-inspiré et des nanotubes de carbone. © CEA
Grâce à la haute tolérance au CO du complexe au nickel, ce système biohybride innovant affiche d’excellentes performances. Il atteint une conversion complète (100 %) et une vitesse de réaction maximale de 30 s-1 pour la réaction WGSR, et ce, à température et pression ambiantes et en absence d’apport d’énergie externe, que le substrat soit du CO pur ou un gaz de synthèse.
Le dispositif développé dans cette étude constitue une première preuve de concept. L’un des enjeux majeurs réside dans le développement de procédés de type Power-to-Syngas, visant à produire du gaz de synthèse à partir d’eau, de CO2 et d’énergie renouvelable, en optimisant la réaction dans le sens inverse. À titre d’exemple, l’électrolyse de l’eau peut être couplée à la réaction WGSR inverse : CO2 + H2 → CO + H2O.
Dans ce contexte, l’optimisation de la réaction WGSR ou son inverse, s’impose comme un axe de recherche prometteur en catalyse pour une chimie durable. Elle ouvre des perspectives pour le développement de procédés de valorisation du CO2 de la biomasse et des déchets, en lien avec les objectifs d’une économie circulaire du carbone.
Financements
- Programme NTE CEA
- Programme ECC CEA
- PEPR SpleenProjet POWERCO2
Collaborations
- Département de Chimie Moléculaire, UGA
- Laboratoire de Bioénergétique et Ingénierie des protéines, CNRS Marseille