L’azote atmosphérique (N2) est, pour l’essentiel, un gaz inerte pour les êtres vivants sur Terre. Autrement dit, nous ne pouvons pas utiliser directement ce composé pourtant vital. Le cycle biochimique de l’azote, et plus particulièrement le rôle joué par certaines bactéries et plantes, est donc essentiel au maintien de la vie sur notre planète. Chez certains micro-organismes, un processus appelé fixation biologique de l’azote permet de transformer l’azote atmosphérique en formes assimilables par les êtres vivants. Ce processus repose sur l’action d’enzymes sensibles à l’oxygène, les nitrogénases, capables de « casser » la molécule d’azote (N2). Pour fonctionner, ces enzymes ont besoin d’un cofacteur métallique, un composant moléculaire complexe dont la construction requiert plusieurs étapes et l’intervention de nombreuses protéines. L’une des protéines clés de ce processus est NifEN, qui agit comme une plateforme d’assemblage permettant d’achever les dernières étapes de la formation du cofacteur avant son incorporation dans la nitrogénase, appelée NifDK. Jusqu’à présent, les bases structurales expliquant comment NifEN accomplit ce rôle central dans la fixation biologique de l’azote restaient inconnues.
Dans l’étude, publiée dans Nature Chemical Biology, les chercheurs ont révélé comment la protéine NifEN accomplit cette fonction. Ils ont eu recours à la cryo-microscopie électronique pour réaliser une analyse structurale à haute résolution de la protéine. Cette technique de pointe leur a permis d’obtenir des images inédites du processus d’assemblage du cofacteur de la nitrogénase. Ces images ont mis en évidence un processus étonnamment dynamique, au cours duquel la protéine NifEN s’ouvre et se referme, certaines de ses régions se déplaçant et se réorganisant pour faciliter le transfert du composé métallique précurseur depuis la surface vers la cavité interne. Les chercheurs ont pu tirer cette conclusion grâce à la découverte cruciale d’intermédiaires montrant la molécule en transit entre ces deux positions. Ces résultats suggèrent que la transformation du précurseur ne se produit pas à la surface de la protéine, comme on le pensait jusqu’à présent, mais bien au sein de sa cavité interne. Cette découverte modifie non seulement notre compréhension de la biosynthèse du cofacteur de la nitrogénase, mais elle éclaire également la divergence évolutive entre NifEN, spécialisée dans la construction du cofacteur, et NifDK, responsable de la fixation de l’azote.
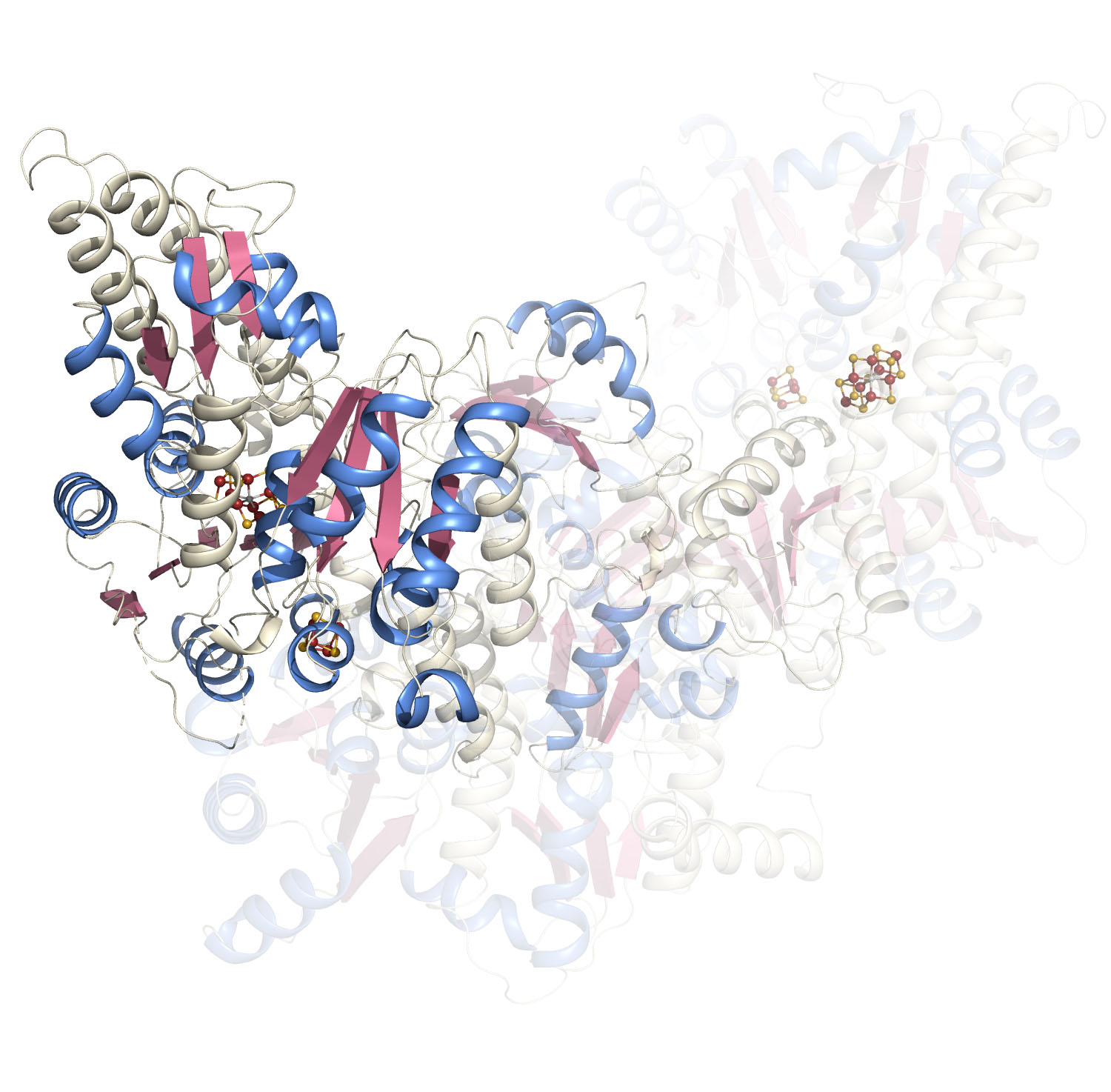
Structure
de la protéine NifEN déterminée par cryo-microscopie électronique.
© CEA-Irig/IBS/Y. Nicolet
Comprendre un tel processus constitue une étape clé vers sa reproduction dans des systèmes non natifs, tels que les cellules eucaryotes. Parvenir à reconstituer la biosynthèse du cofacteur dans ces hôtes pourrait, à terme, permettre l’assemblage d’une nitrogénase pleinement fonctionnelle au sein des cellules végétales, ouvrant ainsi la voie à des cultures capables de fixer leur propre azote et, par conséquent, à une agriculture plus durable et moins dépendante des engrais synthétiques.
cofacteur métallique*: molécule contenant un ou plusieurs ions métalliques, nécessaire à une enzyme pour catalyser une réaction donnée.
Financements :
ANR-15-IDEX-02, ANR-10-INBS-05-02, ANR-17-EURE-0003, ANR-17-EURE-0003, EXC2008-390540038, PRE2018-084951, RD 289/2021 & CEA.
Collaborations :
Institut de Biologie Structurale (IBS) et Centro de Biotecnología y Genómica de Plantas (CBGP).