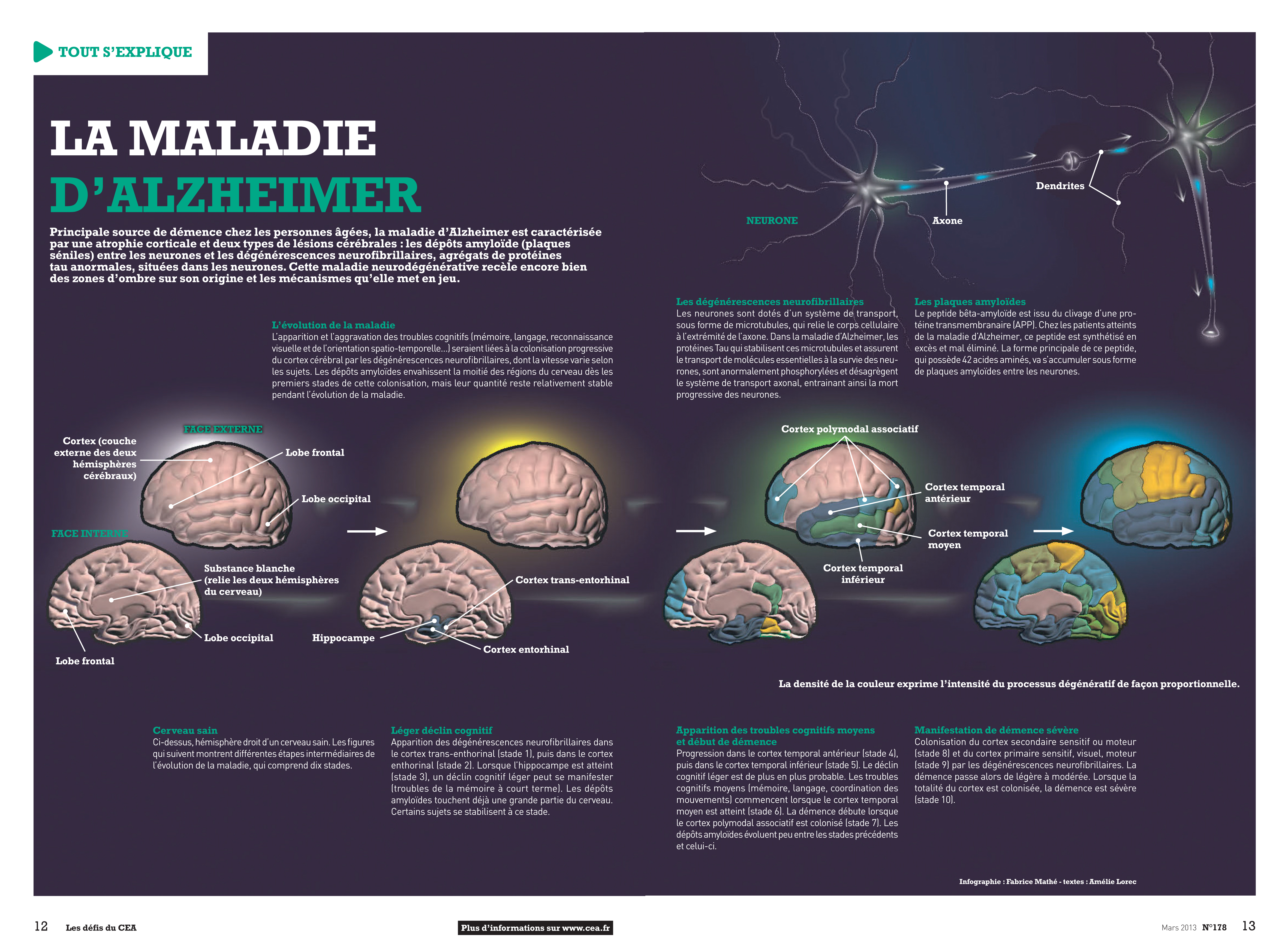
La maladie d’Alzheimer se caractérise par une perte progressive du
volume neuronal, ainsi que par une accumulation de protéines anormales à
l’intérieur des neurones (tau) et à l’extérieur (peptide bêta-amyloïde). Ces
protéines forment des fibres dites amyloïdes, envahissant l’intérieur et
l’extérieur des cellules neuronales et les « étouffant » jusqu’à leur
destruction. Ces empreintes de la maladie apparaissent très tôt, mais
sont difficilement détectables.
Au cours de leurs travaux, les chercheurs ont constaté que le
mouvement des molécules d’eau pourrait constituer un marqueur indirect
de la présence de fibres amyloïdes tau au niveau des neurones. Cette
hypothèse vient d’observations faites par la diffusion de neutrons, une
technique spectroscopique capable de repérer des atomes d’hydrogène et
mesurer ainsi l’amplitude du mouvement des molécules d’eau à l’échelle
nanométrique. Les chercheurs ont tout d’abord créé artificiellement des
fibres amyloïdes in vitro par ajout d’héparane sulfate, un
polysaccharide complexe dont les groupes sulfates sont connus pour
déclencher l’agrégation des protéines tau entre elles. L’objectif étant
d’observer le mouvement de l’eau, ils ont du « masquer » l’hydrogène de
la protéine tau et de l’héparane sulfate en l’échangeant par un de ses
isotopes, le deutérium, grâce à une technologie récemment développée par
l’IBS.
Les résultats de cette étude ont montré que l’eau s’avère
beaucoup plus mobile dans les fibres amyloïdes que sur les protéines
tau non agrégées. « L’accélération concerne 25 % des molécules d’eau
», précisent Yann Fichou et Giorgio Schirò, auteurs de la publication.
Selon les chercheurs, l’augmentation de la mobilité des molécules d’eau
influerait sur le développement des fibres amyloïdes par un effet dit de
« stabilisation entropique ». Cet effet thermodynamique favoriserait
l’agrégation de la protéine tau, aux dépens de l’état normal (non
agrégé), a priori plus stable. « Il faudrait maintenant suivre le mouvement de l’eau durant le processus de formation des fibres, souligne Martin Weik. Il serait intéressant de savoir si la propension à former ces fibres peut être modulée par la dynamique des molécules d’eau. »
Cette collaboration regroupe des chercheurs de l’Institut de
biologie structurale (CEA/CNRS/UJF, Grenoble), en collaboration avec
l’Institut Laue Langevin (Grenoble), le centre de recherche de Jülich
(Allemagne), le Laboratoire des Matériaux et du Génie Physique
(Grenoble) et l’Université de Californie (Etats-Unis)
Ces
résultats ouvrent un nouveau champ de connaissances dans la
compréhension de la pathologie d’Alzheimer. Cette fluidité accrue révèle
en effet la formation de fibres pathogènes et pourrait servir de
marqueur précoce de la maladie. Ces résultats semblent confirmer une
hypothèse et des observations antérieures, par IRM de diffusion, d'une
augmentation de la diffusion de l'eau dans l'hippocampe chez des
patients atteints par la maladie. « Nous avons contacté l’équipe de Denis le Bihan, à NeuroSpin (CEA/NeuroSpin), indiquent les chercheurs de l’IBS. Nous allons collaborer. Il s’agit d’une réelle opportunité pour développer un outil diagnostic inédit. »