De nombreux médicaments ciblent des protéines. Comprendre la dynamique d’une protéine et la façon dont elle se lie à ses partenaires est donc essentiel pour développer de nouvelles molécules thérapeutiques efficaces. Or, la complexité de la vie de beaucoup de protéines, et notamment leur plasticité, avec une structure toujours changeante et dépendante des paramètres extérieurs (partenaires, température, etc.), rend leur étude particulièrement difficile. En outre, cette dynamique est essentielle pour que la protéine puisse interagir avec ses molécules partenaires et ainsi fonctionner. Une équipe de l’IBS (CEA/CNRS/Université Joseph Fourier), en collaboration avec l’EPFL et l’ENS de Lyon, a mis au point une méthode inédite pour étudier la dynamique de ces molécules biologiques très agitées. « L’idée consiste à « endormir » profondément une protéine et à la regarder se réveiller petit à petit jusqu’à devenir fonctionnelle », raconte Martin Blackledge, responsable du groupe « Flexibilité et Dynamique des Protéines par RMN » au sein de l’IBS.
Pour obtenir ce sommeil profond, les chercheurs ont refroidi la protéine à -168°C, température à laquelle les différents composants de la protéine sont figés. En augmentant progressivement la température jusqu’à 7°C, l’équipe a vu ses composants s’éveiller les uns après les autres sous l’agitation thermique, à l’image d’un individu qui, lors du réveil, ouvre d’abord les yeux, s’étire, et mobilise enfin assez d’énergie pour se lever. Cette astuce expérimentale permet de détecter les mouvements individuels des différents composants d’une protéine ainsi que les mouvements collectifs à l’aide d’un dispositif de spectroscopie RMN spécialement adapté et développé par l’équipe de l’IBS. Le procédé expérimental a été testé sur GB1, une classe de protéines interagissant avec les anticorps. Afin de mimer l’environnement de la protéine dans le cytoplasme de la cellule, les chercheurs ont analysé la protéine entourée de molécules d’eau. Lors de la montée en température, ces dernières ont été les premières à s’animer, à -113°C. Les chaînes latérales de la protéine sont ensuite sorties de leur léthargie, suivies par son squelette, à -53°C, température à laquelle la protéine est devenue active. A chaque transition et tout au long du réchauffement, les données de RMN ont permis de visualiser l’interaction entre toutes les parties de la protéine. « C’est la première fois que l’on reconstitue le film du « réveil » d’une protéine avec une telle précision, d’un état inerte à température très basse jusqu’à son état fonctionnel, avec toutes les étapes intermédiaires, souligne le chercheur. Nous avons identifié quelle température, donc quelle énergie, est nécessaire pour franchir la barrière menant d’un état à un autre. »
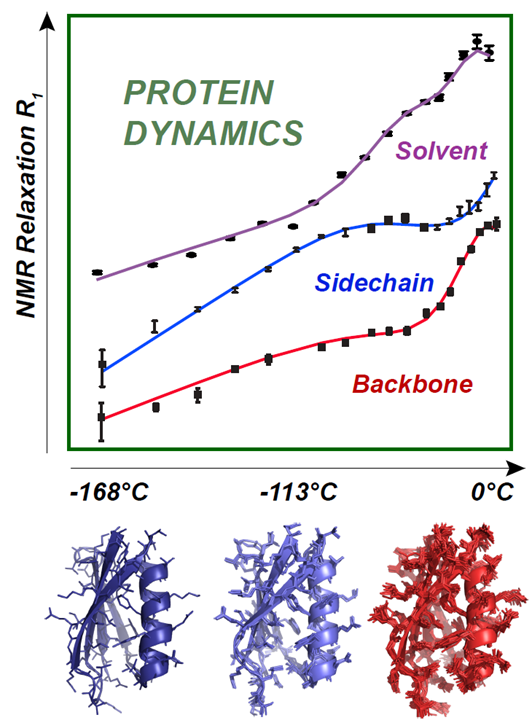
La résonance magnétique nucléaire (RMN) mesurée sur une vaste gamme de température, permet d’analyser, en fonction de l’amplitude et de la fréquence des mouvements, la dynamique des différents composants d’une protéine, pour comprendre comment ils s’articulent ensemble afin de rendre la protéine fonctionnelle.
© M. Blackledge
Ce dispositif de spectroscopie RMN a ainsi montré sa puissance pour reconstituer le film du réveil d’une protéine hydratée, un procédé permettant d’analyser finement les mouvements des différents composants d’une protéine, pour comprendre comment ils s’articulent afin de rendre la protéine fonctionnelle.
[1] Institut de biologie structurale, Grenoble.
[2] École polytechnique fédérale de Lausanne.
[3] Ecole Normale Supérieure.