Dans une cellule, le noyau contient l’essentiel de l’ADN, support de la précieuse information génétique. À ce titre, il joue le rôle de centre de contrôle, orchestrant toutes les réactions se déroulant dans la cellule et nécessaires au bon fonctionnement d’un organisme. La double membrane qui délimite le noyau assure également un rôle protecteur de l’ADN. Pourtant, la réalisation des réactions cellulaires exige que certaines molécules puissent être échangées entre le cytoplasme et le nucléoplasme (intérieur du noyau). Ainsi, certaines d’entre elles franchissent de façon très sélective la double membrane qui constitue l’enveloppe du noyau. Elles sont pour cela acheminées par des protéines appelées ‘’transporteurs’’, qui passent par des pores formant des tunnels à travers l’enveloppe nucléaire. Ces tunnels sont tapissés de nucléoporines désordonnées, c’est-à-dire très flexibles car changeant de conformation en permanence. Ces nucléoporines constituent un filtre sélectif pour le transit de molécules grâce à leurs interactions avec les transporteurs. Le mécanisme de ces interactions, à la fois rapides (quelques millisecondes) et très spécifiques, était resté largement incompris jusqu’à présent.
Les auteurs de l’étude ont combiné différentes techniques expérimentales de visualisation (fluorescence, simulation, résonance magnétique nucléaire – RMN – à très hauts champs) pour comprendre ce mécanisme. Ils ont pu ainsi identifier et suivre une multitude d’interactions faibles, mais très spécifiques, entre les nucléoporines et les transporteurs.
Schéma d’un pore nucléaire et du transit d’une molécule (en bleu) entre le cytoplasme et le noyau. En rouge, les transporteurs, en jaune, les nucléoporines. Ces dernières jouent un rôle de filtre dans le pore de l’enveloppe nucléaire. A droite : les expériences en RMN ont permis d’identifier les zones d’interactions entre les transporteurs et les nucléoporines. En haut, une illustration de l’interaction, en bas un zoom dans les spectres RMN montrant l’interaction par acide aminé de la nucléoporine. © Sigrid Milles / CEA
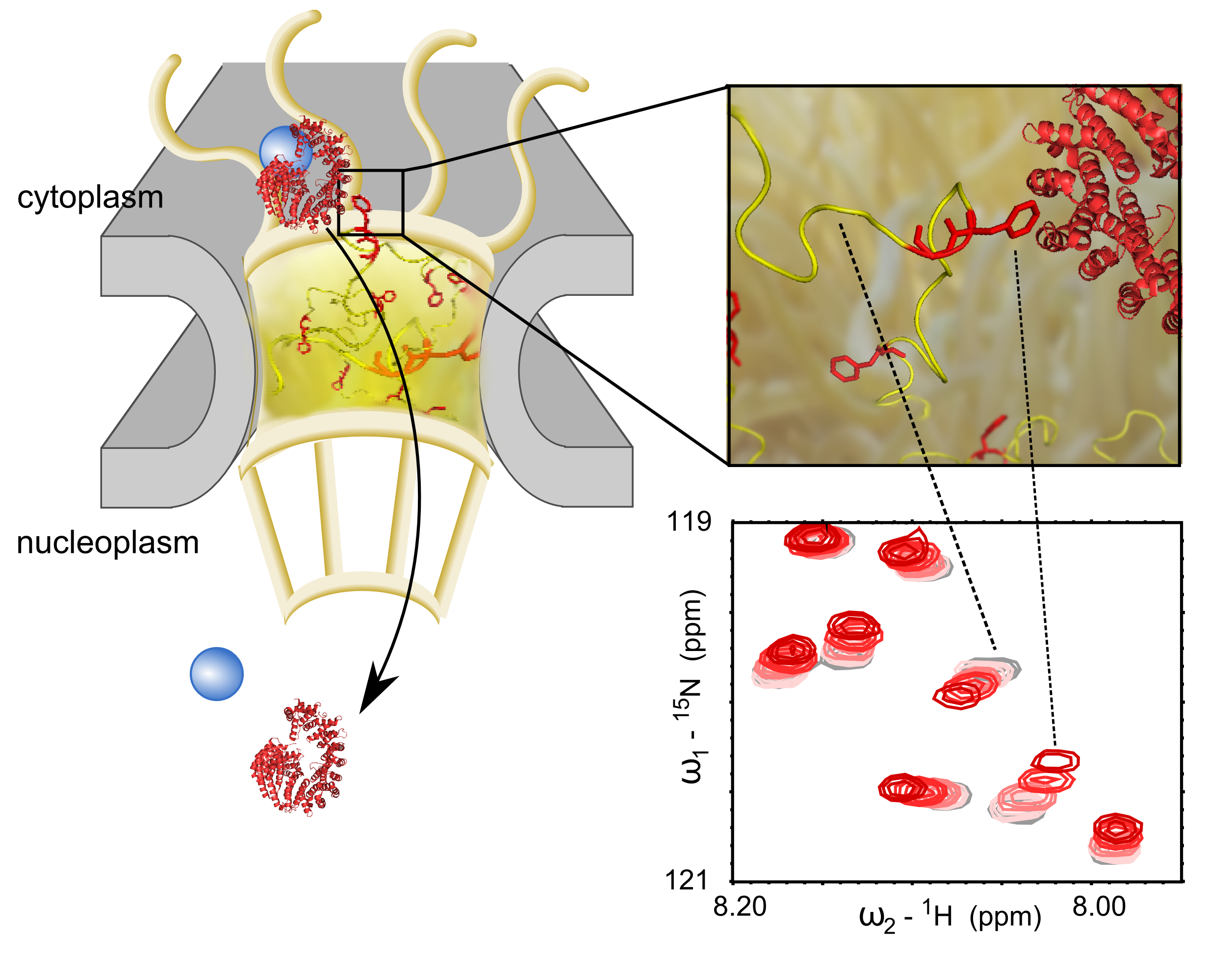
Schéma d’un pore nucléaire et du transit d’une molécule (en bleu) entre le cytoplasme et le noyau. En rouge, les transporteurs, en jaune, les nucléoporines. Ces dernières jouent un rôle de filtre dans le pore de l’enveloppe nucléaire. A droite : les expériences en RMN ont permis d’identifier les zones d’interactions entre les transporteurs et les nucléoporines. En haut, une illustration de l’interaction, en bas un zoom dans les spectres RMN montrant l’interaction par acide aminé de la nucléoporine. © Sigrid Milles / CEA
Une approche multi-technique pour reconstituer les mécanismes d’interaction
Les chercheurs ont utilisé la RMN afin d’identifier, à une résolution atomique, les zones et les mécanismes d’interactions des nucléoporines avec les transporteurs. Malgré la très grande flexibilité de ces protéines, ils ont constaté que des zones de quelques acides aminés seulement sont mises en jeu dans ces interactions. Ces dernières sont de très courte durée, et leur grande spécificité est directement liée à une composition en acides aminés spécifique des petites zones d’interactions. Le reste de la nucléoporine ne participe pas ou peu à l’interaction.
L’équipe a ensuite cherché à identifier, par fluorescence, les dynamiques moléculaires d’interaction (repliement, changement de configurations…) entre les nucléoporines et les transporteurs. Ils ont alors eu la surprise de constater que les interactions avaient lieu de façon très rapide, et que la configuration des protéines n’évoluait pratiquement pas à ce moment-là.
Les chercheurs ont donc pu déterminer que les transporteurs et les nucléoporines interagissent très rapidement et superficiellement en des points spécifiques, ce qui permet d’assurer un passage rapide et sélectif à travers l’enveloppe du noyau. Cette efficacité physiologique est basée sur la plasticité des nucléoporines (pouvant adopter différentes configurations) et la multiplicité de leurs sites d’interactions.