Actualité | Matière ordinaire | Hydrogène | Energies | Synchrotron
Publié dans Nature Communications
Des cages d’azote pour stocker l’hydrogène
 DR
DR
Chapeau
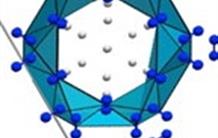
Des composés NHx remarquables, obtenus par compression des mélanges N2-H2 : Des chercheurs du CEA, du CNRS et des Synchrotrons SOLEIL et ESRF ont étudié les composés qui se forment par compression des mélanges N2-H2. L’un d’eux en particulier, de formule (N2)6(H2)7, possède une structure unique dans laquelle des cages d’azote enserrent des molécules d’hydrogène. Par application d’une très haute pression (au-delà de 50 GPa), suivie de décompression, de l’ammoniac NH3 et de l’hydrazine N2H4 sont générés. Ce résultat démontre la possibilité d’induire une réaction chimique sous pression, sans catalyseur, dans des mélanges de molécules simples. Cette découverte pourrait avoir un grand intérêt pour la synthèse de nouveaux matériaux à haute densité d’énergie, ou possédant une très bonne capacité de stockage de l’hydrogène. Ce travail vient d’être publié dans Nature Communications.
Publié le 11 décembre 2014
Corps de texte
Pendant des siècles, alors que l’importance de l’azote était connue pour la croissance des plantes, les sources d’engrais étaient naturelles (notamment le guano), et les gisements très convoités… et épuisables. Pour s’affranchir de cette dépendance aux gisements, les scientifiques ont cherché à trouver une solution alternative. C’est en combinant l’effet de la pression à celui de la température et d’un catalyseur que le chimiste allemand Haber a réussi à provoquer l’hydrogénation du diazote atmosphérique pour former de l’ammoniac. L’application à l’échelle industrielle de ce procédé, dit de Haber-Bosch, a ainsi permis à partir des années 1910 la production massive d’engrais.
De nombreux travaux ont depuis été publiés sur les propriétés de l’hydrogène et de l’azote sous très hautes pressions statiques. Une forme polymérique de l’azote a ainsi été synthétisée au-dessus de 100 GPa (soit près d’un million de fois la pression atmosphérique), ce qui en fait le matériau avec la plus forte densité d’énergie stockée. L’hydrogène métallique fait quant à lui l’objet d’intenses recherches car il aurait des propriétés exceptionnelles, comme celle de conduire l’électricité sans perte (supraconductivité) à température ambiante. Afin de combiner ces deux propriétés (forte densité d’énergie/température de supraconductivité élevée), les scientifiques cherchent à présent à mélanger, sous haute pression, l’azote et l’hydrogène à d’autres éléments. Pourtant, jusqu’alors, les propriétés des mélanges de N2 et d’H2 sous fortes pressions restaient inexplorées.
Dans ce travail, les chercheurs ont étudié différentes concentrations des mélanges N2-H2 sous pression. La solidification de ces mélanges a été obtenue entre 3 et 7 GPa, avec la formation de deux composés (N2)6(H2)7 et N2(H2)2. La structure du composé (N2)6(H2)7 est particulièrement intéressante et totalement originale, avec de larges cages d’azote moléculaire entourant 14 molécules d’hydrogène. C’est le premier exemple d’une telle structure, dite de type clathrate, dans laquelle ce sont des interactions de faible intensité (van der Waals) et non des liaisons chimiques fortes entre les atomes qui sont à la base de la structure du composé.
L’augmentation de pression (50 GPa) sur cette structure-cage favorise une réaction chimique entre les molécules d’azote et d’hydrogène et un nouveau composé est alors formé, constitué d’azote et d’ammoniac ionisé. En diminuant la pression, un mélange azote / hydrazine (N2H4) est récupéré.
Le cycle de pression a ainsi permis de synthétiser un matériau énergétique, l’hydrazine, utilisé en particulier comme carburant de fusées, en partant uniquement d’azote et d’hydrogène et donc sans polluant (ce qui n’est pas possible à pression ambiante).
Ces résultats ouvrent ainsi une nouvelle voie pour la synthèse « propre » de matériaux énergétiques.
Haut de page