L'identification de biomarqueurs est fondamentale pour la compréhension des processus biologiques associés aux maladies neurodégénératives. L'atrophie de certaines structures cérébrales a depuis longtemps été proposée comme un biomarqueur d'intérêt. Cependant, en dépit de sa robustesse et de la facilité de la mesure, l'atrophie des structures fournit peu d'informations sur la physiopathologie de la maladie et n'est probablement que le reflet à long terme d'événements biologiques très anciens.
Dans cette étude publiée dans le journal
NMR in Biomedicine, l'équipe méthodes de résonance magnétique
in vivo pour l'étude du cerveau du
laboratoire des maladies neurodégénératives de MIRCen (CEA-Jacob) identifie des biomarqueurs précoces et pertinents, en particulier dans le contexte de la maladie de Huntington*. Les chercheurs ont mis au point un protocole d'acquisition à haut champ magnétique (11,7 Tesla) combinant la spécificité biologique fournie par la spectroscopie RMN (résonance magnétique nucléaire) du proton et la haute résolution spatiale offerte par l'imagerie métabolique du glutamate (gluCEST).
Deux modèles murins de la maladie de Huntington présentant des caractéristiques très différentes ont été étudiés : le modèle Ki140CAG caractérisé par une progression lente de la maladie, assez similaire aux formes pré-symptomatiques observées chez l'homme, et le modèle R6/1 qui lui, tend à reproduire la forme plus précoce et agressive de la maladie.
Grâce à l'approche combinée de la spectroscopie et de l'imagerie métabolique, l'étude a pu mettre en évidence des différences frappantes entre ces deux modèles. Dans le modèle R6/1, la diminution des niveaux de N-acétyl-aspartate, un métabolite principalement situé dans les neurones, suggère une altération du compartiment neuronal. De plus, cette diminution est corrélée à l'atrophie du striatum, une structure précocement atteinte dans la maladie de Huntington. En revanche, la stabilité des autres métabolites tend à montrer qu'un autre type cellulaire, les astrocytes, ne sont pas affectés et que le métabolisme énergétique est préservé. Dans le modèle Ki140CAG, qui présente une apparition plus lente des symptômes, la modification des taux de plusieurs métabolites peut refléter des changements qui seraient mis en place progressivement dans le cerveau afin de compenser des déficits survenus plus tôt dans la vie des souris. Par ailleurs, l'imagerie gluCEST a permis de mettre en évidence des altérations dans des régions cérébrales inattendues telles que le corps calleux, mesures qui auraient été inaccessibles à la spectroscopie RMN.
La complémentarité des deux méthodes et leur utilisation combinée dans un même protocole permet de fournir différents angles de vue de l'évolution de la pathologie. Cela pourrait permettre d'améliorer l'utilisation de modèles animaux pour l'étude d'un large spectre de maladies neurodégénératives et également d'évaluer l'efficacité de futurs traitements.
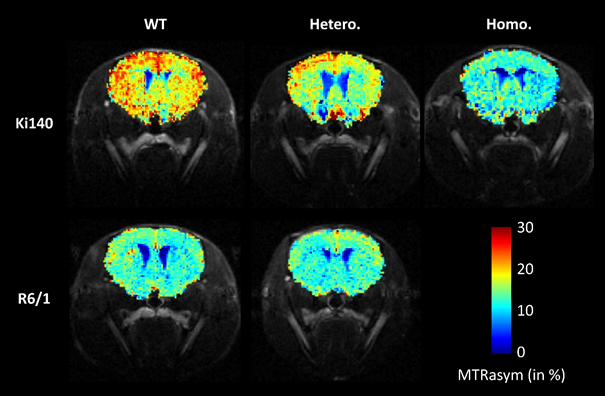
Imagerie métabolique du glutamate (gluCEST) acquise chez les souris Ki140CAG (ligne du haut) et R6/1 (ligne du bas). Les souris Ki140CAG homozygotes pour le gène codant pour la huntingtine mutée (Homo., colonne de droite) présentent des taux de glutamate diminués par rapport aux souris sauvages (WT, colonne de gauche). Les souris hétérozygotes présentent des taux intermédiaires (Hetero., colonne du milieu), suggérant une corrélation entre les taux de glutamate et la sévérité de la maladie. En revanche, les souris R6/1 hétérozygotes présentent des taux de glutamate comparables aux souris sauvages, ce qui est propre à ce modèle animal, et qui a pu être mis en évidence grâce au protocole développé dans cette étude. © J. Flament / MIRCen
* La maladie de Huntington est une maladie génétique rare et héréditaire, pour laquelle il n'existe actuellement aucun traitement curatif. Elle est associée à la dégénérescence de neurones d'une partie du cerveau impliqués dans des fonctions motrices, cognitives et comportementales.