L'instabilité génomique est une des caractéristiques contribuant au vieillissement et au développement tumoral via l'acquisition d'altérations génétiques. Les mécanismes de réparation des lésions de l'ADN sont donc essentiels à la survie des cellules et des organismes vivants. Parmi eux, la recombinaison homologue (RH) joue un rôle central dans la réparation et le maintien de la stabilité du génome. Ce mécanisme est conservé chez tous les organismes vivants, des bactéries à l'Homme. La protéine clef de ce processus, la recombinase Rad51, forme des oligomères sur l'ADN endommagé avec l'aide de protéines accessoires médiatrices telles que BRCA2, à la recherche de séquences d'ADN identiques pour les utiliser comme matrice et assurer ainsi une réparation fidèle des lésions.
En raison de son importance dans le maintien de la stabilité du génome, la recombinaison homologue est généralement considérée comme un mécanisme de suppression des tumeurs. En accord avec cette théorie, de nombreux gènes de recombinaison homologue (notamment BRCA1 et BRCA2) sont mutés dans les tumeurs, en particulier dans les cancers héréditaires du sein et de l'ovaire. Étonnamment, malgré le rôle clé de Rad51 dans la recombinaison homologue, son inactivation dans les tumeurs n'est cependant pas observée, ce qui constitue le "paradoxe RAD51".
Parmi les nombreuses hypothèses émises pour expliquer ce paradoxe, l'une d'elle suggère que les protéines accessoires (telles que BRCA1/2), si elles sont mutées, empêchent rad51 de se lier à l'ADN. L'ADN serait ainsi plus accessible et vulnérable à d'autres mécanismes alternatifs de réparation mutagènes augmentant de ce fait l'instabilité génétique. Cette hypothèse soulève donc la question suivante : quel processus est à l'origine du développement tumoral : la désactivation de la recombinaison homologue ou la stimulation concomitante de voies de réparation non conservées mutagènes ?
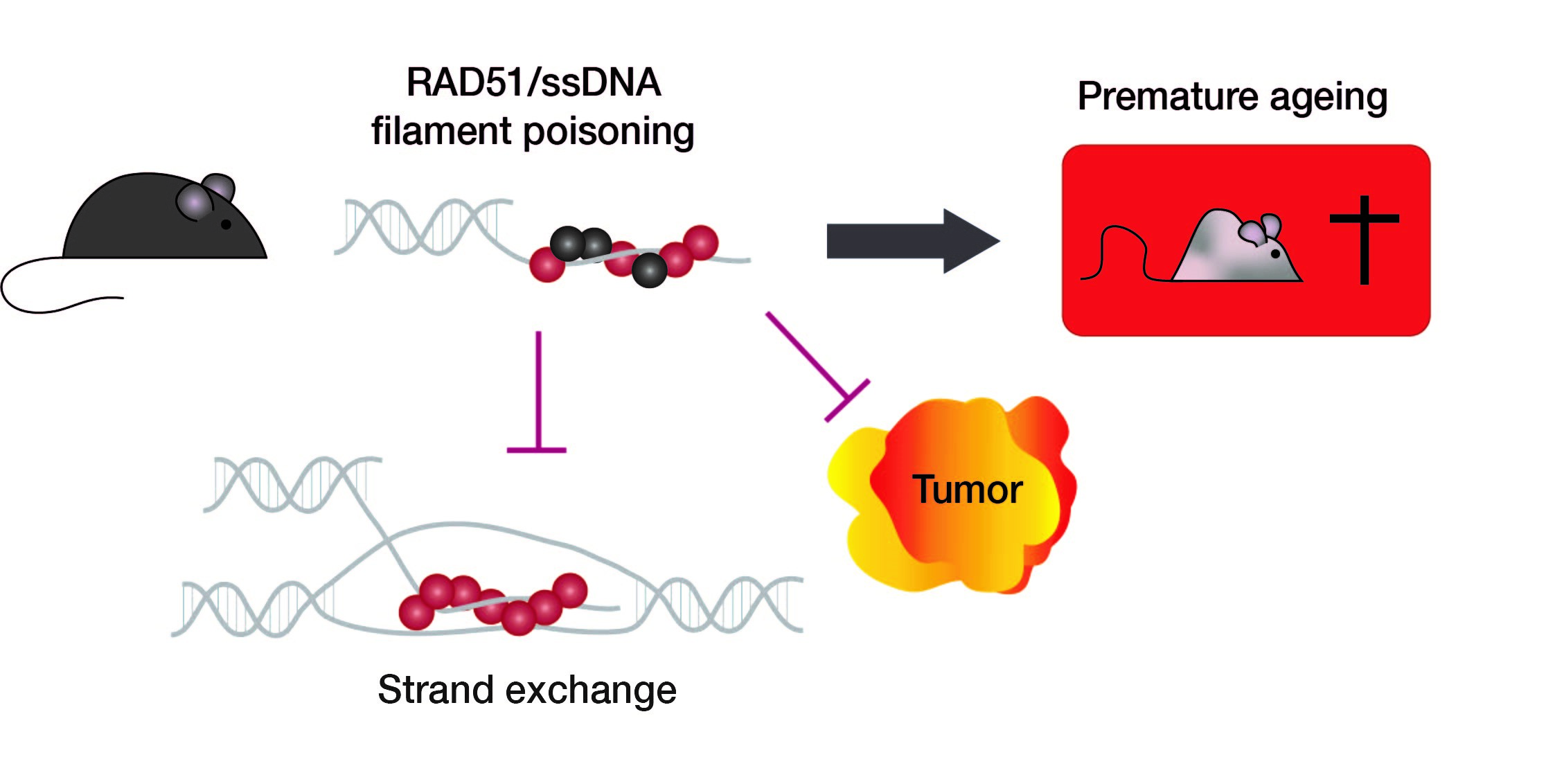
Pour répondre à cette question, les chercheurs du Laboratoire de Développement des Gonades (iRCM) en collaboration avec l'équipe Stabilité instabilité du génome (Institut Cochin) ont développé un modèle murin exprimant une forme dominante négative de RAD51, SMRad51. SmRad51 est un gène chimérique dont l'expression ectopique inhibe le processus de recombinaison homologue médié par la protéine Rad51 exprimée de manière endogène. Cependant, en se fixant sur l'ADN endommagé, la protéine SMRad51 empêche la stimulation de voies alternatives de réparation mutagènes. SMRad51 représente donc un outil expérimental unique permettant de séparer l'activité de recombinaison homologue de la protection contre les mécanismes non conservés de réparation mutagènes.
L'inactivation de RAD51 entrainant une létalité embryonnaire précoce, les chercheurs ont construit un modèle murin permettant l'expression conditionnelle de SMRad51 en établissant une construction génétique permettant son expression en présence de Doxycycline (pour déclencher ou réprimer l'expression du gène chimérique à n'importe quel moment de la vie de l'animal).
Ils ont observé que la suppression de la recombinaison homologue par l'expression de SMRad51 entraînait un stress réplicatif, une inflammation systémique, un épuisement des cellules souches progénitrices, un vieillissement prématuré et une réduction de la durée de vie des souris, mais pas la formation de tumeurs.
Pour mieux comprendre le rôle joué par SMRad51 dans le développement tumoral, les chercheurs ont croisé des modèles murins exprimant SMRad51 avec des modèles murins ayant une prédisposition à développer un cancer du sein. Ils ont noté que l'expression de SMRad51 diminue à la fois la fréquence et la taille des tumeurs mammaires.
L'ensemble des données obtenues dans cette étude montre que la réduction spécifique de la recombinaison homologue médiée par Rad51, sans stimulation concomitante des voies de réparation alternatives mutagènes, conduit principalement au vieillissement et non à l'oncogenèse, et même prévient le développement tumoral.
© Bernard Lopez / CNRS / Institut Cochin
Ces travaux mettent en lumière l'importance de l'activité de Rad51 dans l'équilibre oncogenèse/vieillissement en proposant une concurrence possible plutôt qu'une coopération entre ces deux processus.