OBJECTIF 2 : Positionner HLA-G comme marqueur diagnostique de la stabilité du greffon et outil thérapeutique anti-rejet lors de thérapies allogéniques.
Depuis que le SRHI a décrit pour la première fois l'expression de HLA-G dans le contexte de la transplantation cardiaque en 2000, notre équipe a démontré qu'après une transplantation d'organe solide (cœur, poumon, rein et foie), l'expression de HLA-G était significativement observée chez les patients stables et non les patients en rejet. En accord avec cette observation, l'équipe de recherche a constaté une diminution des anticorps anti-HLA, connus pour être impliqués dans le rejet d'allogreffe, chez les receveurs HLA-G+. Dans ce contexte, HLA-G est présent dans les cellules transplantées (analyse immunohistochimique du greffon) et dans le plasma (où les formes solubles de HLA-G sont mesurées par ELISA). Ces études ont permis de considérer HLA-G comme marqueur permettant d'identifier les patients présentant un faible risque de rejet et comme cible thérapeutique dans la définition de nouveaux traitements anti-rejet.
Rôle de la molécule HLA-G en transplantation pulmonaire en tant que marqueur prédictif de survie du greffon et cible thérapeutique anti-rejet
Au cours des dernières années, l'équipe du SRHI a concentré ses efforts sur la compréhension du potentiel diagnostique et thérapeutique de HLA-G dans la transplantation pulmonaire (LTx) et elle poursuit dans cette voie. Après une LTx, le pronostic vital est associé à l'apparition d'un rejet chronique sous la forme d'un syndrome de bronchiolite oblitérante (BOS). Il est donc important de disposer de marqueurs prédictifs de l'évolution du greffon. À cet égard, le SRHI avait précédemment montré que l'expression de HLA-G par le tissu greffé est associée à l'acceptation de l'allogreffe. En vue d'identifier des marqueurs non invasifs, nous avons récemment décrit (i) qu'une proportion accrue de lymphocytes T périphériques CD4+CD57+ILT2+ au cours de la première année suivant la LTx (Brugière, JHLT 2022 et brevet CEA-FOCH), et (ii) des taux plasmatiques accrus de HLA-G vésiculaire (brevet CEA-FOCH en cours) permettent de distinguer les patients qui subiront un rejet ultérieur de ceux qui resteront stables 3 ans après la greffe. Le projet futur vise à explorer la nature, l'origine, la fonction et l'utilisation clinique de ces vésicules extracellulaires hébergeant HLA-G (EVs HLA-G+) en partant de l'hypothèse qu'elles proviennent du greffon, qu'elles sont tolérogènes et qu'elles pourraient servir de marqueur prédictif non invasif ainsi que de nouvel outil thérapeutique contre le rejet. Ce projet est mené en collaboration avec (i) l'hôpital Foch (Olivier Brugière, service LTx, accès à la cohorte multicentrique nationale COLT) et (ii) le laboratoire des particules et des systèmes complexes de la Faculté des Saints-Pères (Florence Gazeau), expert en biologie et en utilisation thérapeutique des EVs. (i) Une analyse par spectrométrie de flux sera réalisée en vue de définir l'origine des VE provenant de patients LTx, avec des marqueurs spécifiques des cellules épithéliales et immunitaires et (ii) des tests immunologiques (MLR, sécrétion de cytokines, etc.) pour évaluer la fonction des VE HLA-G+ provenant de lignées cellulaires HLA-G+ (preuve de concept) et de patients LTx (pertinence clinique).
HLA-G et thérapie cellulaire allogénique
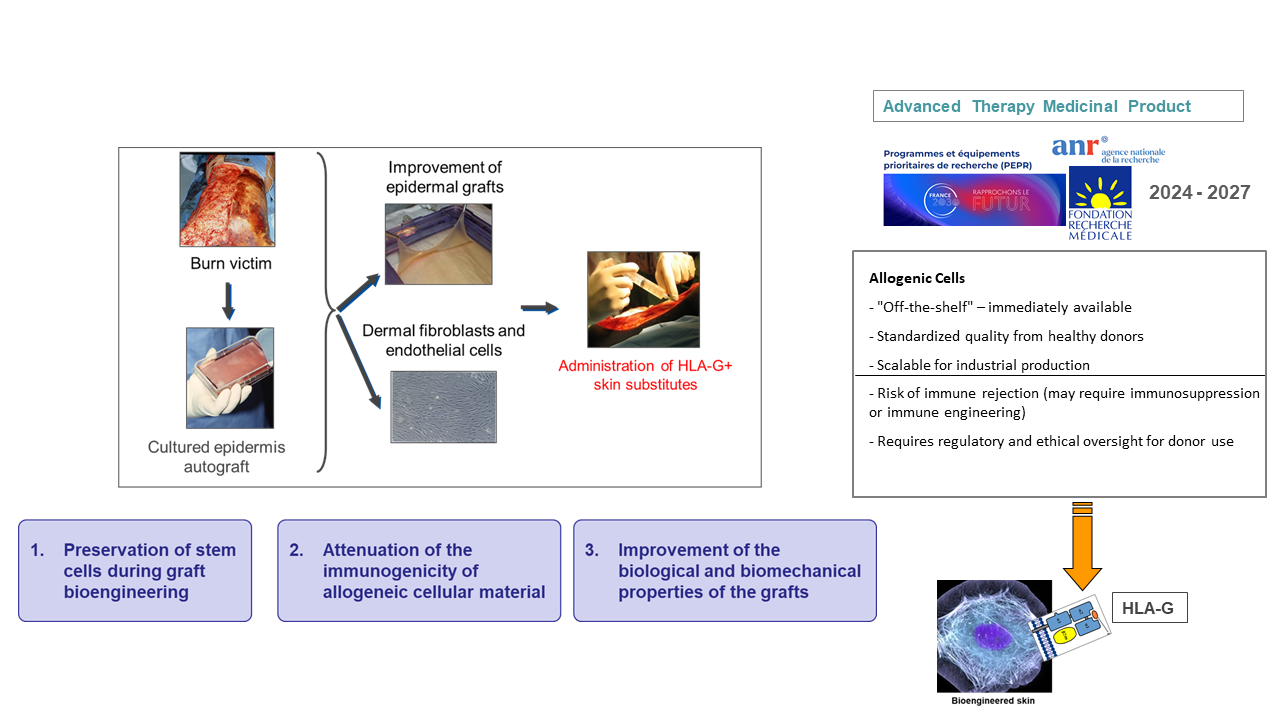
Ce projet s'inscrit dans la continuité de nos récents résultats sur le rôle de HLA-G permettant à des kératinocytes en culture primaire d'acquérir des propriétés immunomodulatrices (Mestrallet, Cells 2021 et Front Immunol 2022). Nous étudions actuellement l'immunomodulation médiée par HLA-G pour améliorer la tolérance des greffes de peau autologues, qui sont généralement réalisées dans un contexte inflammatoire, ou des bio-bandages cutanés allogéniques, qui sont confrontés à un rejet immunitaire.
Les greffes de peau concernent différentes spécialités chirurgicales, telles que l'orthopédie ou la chirurgie plastique et maxillo-faciale. Elles jouent un rôle central dans la prise en charge des brûlures graves. Des innovations dans le domaine de l'ingénierie tissulaire sont néanmoins essentielles pour permettre une bioproduction standardisée à plus grande échelle de greffes cutanées, garantissant une sécurité totale pour le patient. Ce projet se concentre sur l'un des facteurs conditionnant leur efficacité thérapeutique : le maintien sous contrôle des paramètres immunologiques susceptibles de compromettre la prise à long terme, qui limite actuellement l'utilisation des bio-pansements allogéniques. Ce projet s'inscrit dans une stratégie dont l'objectif est la conception d'une peau composite bio-conçue de nouvelle génération présentant une tolérance immunitaire supérieure à celle des modèles de greffons actuels. Cette approche vise à tirer parti des propriétés tolérogènes de l'HLA-G, actuellement étudiées dans les kératinocytes épidermiques humains. Dans le cadre de ce projet, nous proposons de mettre en œuvre ce concept dans une greffe de peau bio-conçue en trois dimensions comprenant les deux compartiments du tissu cutané, le derme et l'épiderme. L'action immunomodulatrice médiée par l'isoforme HLA-G membranaire (c'est-à-dire HLA-G1) d devrait favoriser l'immunotolérance envers l'épiderme greffé. Des fibroblastes exprimant HLA-G seront également utilisés pour coloniser la composante dermique des organoïdes et tester leur intérêt en tant que vecteurs d'un signal immunomodulateur dans la partie profonde du tissu. L'un des atouts de cette approche réside dans l'impact ciblé de HLA-G. Cet effecteur ne modifie pas la défense contre les agents pathogènes, l'effet escompté étant la protection des cellules transplantées. Les perspectives concernent l'amélioration des greffes de peau chez les patients gravement brûlés ou irradiés, ainsi que la chirurgie régénérative et reconstructive. Ce projet est subventionné par la FRM (2023-2027) et est dirigé par Nicolas Fortunel (CEA-Evry-LGRK), expert en biologie cutanée. Il rassemble des équipes d'experts en immunologie HLA-G (notre équipe), en études précliniques (porcines) et cliniques sur les greffes (Alexandre Lellouch, hôpital Tenon, Paris), et en remplacement cutané (JJ Lataillade et Stéphane Banzet, IRBA/CTSA, hôpital Percy). Capitalisant sur le travail accompli et l'expérience acquise au cours de ce premier projet sur l'ingénierie tissulaire avec HLA-G, nous souhaitons dans le futur transposer cette approche afin d'obtenir des organes solides tolérogènes exprimant HLA-G.