Précision préalable : le suffixe « oïde » signifiant « qui ressemble à », les organoïdes ne sauraient être qualifiés de mini-organes mais plutôt de modèles humains in vitro. Il s'agit en effet d'agrégats cellulaires 3D s'auto-organisant dans un hydrogel en milieu de culture et exprimant différentes caractéristiques physiologiques d'un organe ou d'un tissu. Ce support très utile pour évaluer l'efficacité thérapeutique de médicaments ou de nouvelles molécules se heurtent toutefois à trois limites principales :
- du fait de leur auto-organisation à partir de cellules souches pluripotentes pouvant engendrer n'importe quel type de cellules de l'organisme, les organoïdes présentent une grande variabilité de destin en 3D et donc une faible reproductibilité ;
- leur maturation et croissance sont altérées car ils ne sont pas vascularisés ;
- leur développement se limitant au stade embryonnaire, ils sont peu représentatifs d'un organe adulte.
Le graal de la vascularisation des organoïdes
Ce sont à ces limites que les chercheurs du CEA-Irig se sont attelés. Pour la première fois au monde, ils sont parvenus à vasculariser des organoïdes in vitro et à observer leur maturation aussi efficace que dans le cas d'une vascularisation réalisée in vivo grâce à une xénogreffe chez l'animal.
Cette vascularisation consiste en un réseau fluidique d'échanges et de transport de nutriments et d'oxygène mimant le rôle du flux sanguin. « L'organoïde, le tumoroïde ou l'explant tissulaire que l'on « piège » sur la puce contient déjà ses propres cellules sanguines préfigurant une vascularisation mais elles ne sont reliées à rien. D'où l'idée de les connecter à un réseau vascularisé in vitro, réalisé à partir de cellules endothéliales (l'un des types de cellules formant le système sanguin) placées dans un hydrogel, qui se développe autour de ces structures pluricellulaires 3D », détaille Xavier Gidrol, biologiste à l'Irig et co-directeur du PEPR MED-OOC de France 2030 dédié aux recherches dans ce domaine très émergent.
Une plateforme microfluidique agile et sélective
Pour ce faire, les chercheurs ont développé avec l'expertise du CEA-Leti une plateforme microfluidique qui permet de contrôler finement la formation de ces réseaux endothéliaux et d'établir des connexions avec les organoïdes tout en assurant leur perfusion.
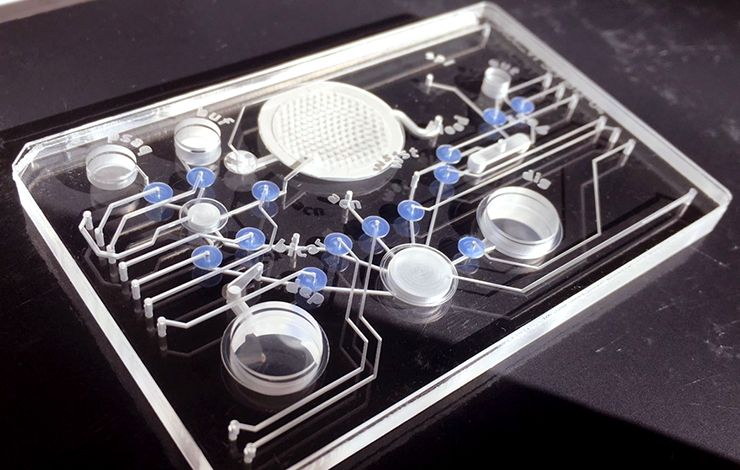
Alors que la plupart des dispositifs existants ne parviennent pas à reproduire fidèlement les caractéristiques du flux sanguin, la plateforme du CEA présente des dynamiques, vitesses et débits de flux similaires. Son architecture permet également la mise en œuvre d'une approche innovante, celle du piégeage des organoïdes que décrit Xavier Gidrol : « au lieu de déposer aléatoirement l'organoïde sur la puce, nous le piégeons automatiquement en un seul et même endroit ce qui permet de l'imager précisément ainsi que ses échanges avec le réseau endothélial. Nous avons réussi à piéger des organoïdes avec un taux de succès de 95 % et de manière très sélective en jouant sur la taille des pièges ce qui permet de pallier la trop grande variabilité de ces agrégats cellulaires 3D. »
Grâce à la vascularisation in vitro des organoïdes et à leur maintien en culture jusqu'à 30 jours, l'équipe a pu observer une amélioration significative de leur croissance et maturation ainsi que de leur fonction physiologique, pratiquement équivalente à celle observée après xénogreffe chez la souris. Cette technologie propose donc une remarquable avancée.