L'hématopoïèse humaine – production de cellules sanguines à partir de cellules souches – se déroule dans la moelle osseuse, un microenvironnement complexe et difficile à reproduire expérimentalement. Les modèles murins classiques d'étude de l'hématopoïèse humaine utilisent des souris immunodéficientes. Ils permettent de progresser, mais leur pertinence physiologique est limitée car les cellules humaines se développent dans une moelle osseuse de souris.
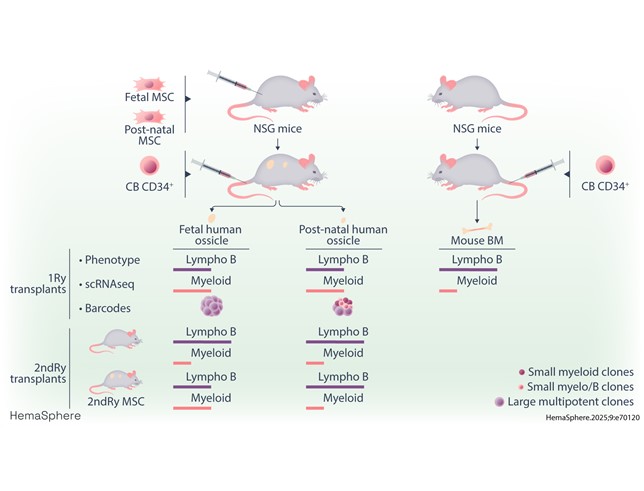
Dans cette étude, l'équipe du DRCM a développé et caractérisé un modèle alternatif : des ossicules humanisés (hOss), structures osseuses dérivées de cellules souches/stromales mésenchymateuses humaines isolées avant ou après la naissance et implantées dans des souris immunodéficientes. Après injection de cellules souches/progénitrices hématopoïétiques CD34+, ces hOss soutiennent efficacement une hématopoïèse humaine multi-lignée.
Les résultats montrent que :
- Les hOss favorisent la production de myélocytes (granulocytes, monocytes) et érythrocytes par rapport aux lymphocytes B, reflétant plus fidèlement les proportions observées dans la moelle osseuse humaine que dans les modèles murins classiques.
- Les hOss contiennent des cellules souches mésenchymateuses ré-isolables, capables de reformer des hOss secondaires avec des niches fonctionnelles pour de l'hématopoïèse humaine.
- Les cellules souches récupérées des hOss présentent un potentiel de régénération sanguine amélioré par rapport à celles isolées de moelle osseuse murine.
- Le suivi clonotypique par codes-barres génétiques révèle des échanges et une complémentarité entre hOss et moelle murine, mais avec une contribution spécifique des hOss au soutien des lignées myéloïdes et multipotentes.
Des différences apparaissent selon l'origine fœtale ou post-natale des cellules stromales: les hOss fœtaux semblent offrir un environnement plus équilibré et durable pour la production hématopoïétique.
Ces résultats établissent les hOss comme un modèle robuste et physiologiquement pertinent pour étudier le développement normal et pathologique des cellules sanguines humaines ainsi que des mécanismes métastatiques de tumeurs solides. L'étude ouvre donc des perspectives pour la recherche sur les leucémies, les interactions protectrices entre cellules cancéreuses et cellules de moelle osseuse et pourraient permettre le développement de thérapies personnalisées.
Contact : Françoise Pflumio ; Laurent Renou