
L’algue brune Laminaria digitata sur les côtes bretonnes
Photo : Stéphane Labarre, UMR7139
Du point de vue évolutif, les algues sont un groupe hétérogène incluant des organismes de plusieurs lignées distinctes. Les algues brunes, ou la classe des Phaeophyceae, font partie d’un groupe d’organismes appelé hétérokontes (qui comprend également les diatomées et les oomycètes) assez éloigné des algues vertes et rouges (Baldauf, 2003). La vaste majorité des algues brunes occupe les environnements marins. Tous les membres de ce groupe sont pluricellulaires avec des morphologies variées allant de filaments branchés à des thalles parenchymateux complexes comprenant des tissus conducteurs. Le thalle du varech Macrocystis pyrifera, par exemple, peut atteindre jusqu’à 70 mètres de long. La couleur des algues brunes est due à la présence de fucoxanthine, un pigment xanthophylle et la principale source de carbohydrate est laminaran (plutôt que l’amidon). En plus de la cellulose, les parois cellulaires des algues brunes sont constituées d’autres polysaccharides comme les alginates et les fucanes.
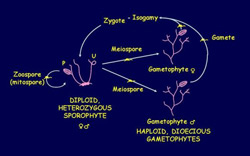
Le cycle haplo-diploïde d’Ectocarpus sil
iculosus
Les sporophytes et les gamétophytes sont légèrement hétéromorphes, les gamétophytes sont dioïques et la détermination du sexe est génotypique.
U : sporange uniloculaire, P : sporange pluriloculaire
Complexe pluricellulaire - Les complexes pluricellulaires sont rarement apparus durant l’évolution et les algues brunes sont l’une des cinq lignées eucaryotes qui ont évolué de cette façon (les quatre autres étant les animaux, les plantes vertes/algues, les champignons et les algues rouges). On suppose que les mécanismes de contrôle du développement nécessaires à la construction d’un organisme pluricellulaire ont évolué indépendamment dans chacune de ces lignées. Chez les animaux et les plantes supérieures, les bases moléculaires de nombreux processus développementaux sont bien compris mais de façon surprenante si l’on considère l’importance fondamentale du développement pluricellulaire, très peu de choses sont connues au sujet de ce processus dans les trois autres lignées, voire quasiment rien sur les bases moléculaires du développement des algues brunes et rouges.
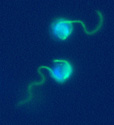
Gamètes d’Ectocarpus :
(Echelle : le diamètre du gamète le plus bas est de 7 µm)
Photo : Delphine Scornet, UMR7139
Cycle de vie et modes de reproduction - En plus d’être d’un intérêt général comme organismes pluricellulaires complexes, les algues brunes montrent des caractéristiques particulières dans leurs cycles de vie et leurs comportements lors de la reproduction. Les cycles de vie passent du diplontique chez le Fucus au presqu’isomorphique cycle haplo-diploïde d’Ectocarpus alors que leurs systèmes sexuels incluent des états à la fois dioïques et hermaphrodites, et l’isogamie, l’anisogamie ou l’oogamie. Le cycle haplo-diploïde tel que celui d’Ectocarpus possède un intérêt particulier car il implique l’existence de mécanismes génétiques de contrôle qui régulent le déploiement des deux alternatives que sont les programmes de développement indépendants et l’influence du développement au niveau de l’organisme entier.
Embryogenèse précoce - Chez les algues brunes, la fécondation est externe et implique la fusion de gamètes nus relachés dans l’eau de mer. Cette caractéristique a été généralement exploitée pour étudier plusieurs aspects du développement précoce tels que la fusion des gamètes lors de la fécondation, l’établissement de la polarité, l’implication de la paroi cellulaire dans les signaux de développement, l’initiation du premier cycle cellulaire, le couplage entre le cycle cellulaire et les processus de développement et d’autres aspects du développement durant l’embryogenèse précoce (Berger et al., 1994 ; Bouget
et al., 1998 ; Corellou et al., 2000, 2001 ; Brownlee
et al., 2001). Plusieurs phénomènes cellulaires sont nouveaux dans ce groupe : la cytokinèse par exemple montre des caractéristiques typiques à la fois des animaux et des plantes terrestres (Nagasato and Motomura, 2002)
Endosymbiose et origine des chloroplastes - On pense que les chloroplastes des plantes vertes et des algues rouges dérivent d’une ancienne cyanobactérie engloutie par une cellule hôte eucaryote. L’origine des chloroplastes des hétérokontes, comme les algues brunes, est plus compliquée. Ils ont été acquis par un évènement secondaire d’endosymbiose au cours duquel un organisme similaire à une algue rouge et possédant des chloroplastes a été lui-même englouti par un autre eucaryote (Yoon et al., 2002). Cette évolution, qui confère aux chloroplastes des algues brunes des caractéristiques particulières telles que quatre membranes concentriques entourant l’organite, implique plusieurs phases de transferts de gènes dans le noyau. La séquence du génome d’Ectocarpus pemettra de tracer ces évènements au niveau génétique.
Réponse au stress biotique et abiotique - Les habitats précaires de la plupart des algues brunes sont des environnements stressants qui soumettent ces organismes à la fois à des agressions biotiques de la part des herbivores et des pathogènes et divers stress abiotiques comme les variations importantes de température, l’immersion, l’irradiation par la lumière et les forces mécaniques. En conséquence, les algues brunes représentent un nouveau système modèle pour l’étude de plusieurs aspects des réponses aux stress biotique et abiotique comme l’immunité innée (Potin
et al., 2002), les infections virales (Müller
et al., 1998 ; Delaroque et al., 2001), les nouveaux systèmes pathogènes (Küpper
et al., 2001, 2002 ; Maier
et al., 2000) et le stress osmotique (Coelho
et al., 2002).
Utilisation industrielle et production de molécules bioactives - En plus des points fondamentaux décrits ci-dessus, il est important de noter que les algues représentent également une ressource marine utilisée dans des secteurs aussi variés que l’alimentation, les cosmétiques et les engrais avec un chiffre d’affaires annuel estimé à 4,5 milliards d’euros (McHugh, 2003). Une nouvelle utilisation émerge à l’heure actuelle source de molécules bioactives, un exemple étant le IODUS 40, une formule dérivée du glucane de Laminaria digitata qui stimule les réponses naturelles de défense des plantes cultivées.

Un sporophyte d’Ectocarpus en culture
Photo : Delphine Scornet, UMR7139
Ectocarpus siliculosus : un modèle génétique et génomique
Les algues brunes de l’ordre des Laminariales et des Fucales ont été très étudiées dans le passé mais ces modèles sont mal adaptés pour des approches génomiques et génétiques en raison de leur grand génome (700 et 1100 Mbp respectivement) et du fait de la grande difficulté à reproduire leurs cycles de vie en laboratoire. Pour pallier ce problème, un tour d’horizon des espèces d’algues brunes a été entrepris à Roscoff (Peters
et al., 2004a) qui a abouti au choix de l’algue filamenteuse Ectocarpus siliculosus déjà étudiée pendant de nombreuses années par Dieter Müller à l’Université de Konstanz en tant qu’espèce modèle de ce groupe. Le choix d’Ectocarpus s’est fait sur la base de plusieurs caractéristiques comme sa petite taille, le fait que le cycle de vie entier peut être reproduit en boïte de Petri en laboratoire (Müller
et al., 1998), sa grande fertilité et sa croissance rapide (le cylce de vie peut être réalisé en 2-3 mois), la facilité des croisements génétiques (Peters et al., 2004b) et la relativement petite taille de son génome. De plus, les Ectocarpales sont très liées Laminariales, un groupe d’algues brunes d’importance économique majeure (Draisma et al., 2003). Plusieurs outils de génétique moléculaire ont été développés pour Ectocarpus comme des protocoles de transformation et d’ARN interférent. Des lignées de mutants peuvent être créées par irradiation aux UV et la sélection de s mutants est grandement facilitées par l’existence d’une phase haploïde dans le cycle de vie.
Bibliographie
-
Baldauf S.L., Roger A.J., Wenk-Siefert I. and Doolittle W.F.
« A kingdom-level phylogeny of eukaryotes based on combined protein data »
Science. (2000) 290 : 972-977. -
Berger, F., Taylor, A. and Brownlee, C.
« Cell fate determination by the cell wall in early Fucus development »
Science. (1994) 263, 1421-1423. -
Bouget F.Y., Berger F. and Brownlee C. .
« Position dependent control of cell fate in the Fucus embryo : role of intercellular communication »
Development.(1998) 125 : 1999-2008. -
Brownlee C., Bouget F.Y. and Corellou F.
« Choosing sides : establishment of polarity in zygotes of fucoid algae »
Semin Cell Dev Biol. (2001) 12 : 345-351 -
Coelho S.M., Taylor A.R., Ryan K.P., Sousa-Pinto I., Brown M.T. and Brownlee C.
« Spatiotemporal patterning of reactive oxygen production and Ca(2+) wave propagation in Fucus rhizoid cells »
Plant Cell. (2002) 14:2369-2381. -
Corellou F., Bisgrove S.R., Kropf D.L., Meijer L., Kloareg B. and Bouget F.Y.
« A S/M DNA replication checkpoint prevents nuclear and cytoplasmic events of cell division including centrosomal axis alignment and inhibits activation of cyclin-dependent kinase-like proteins in fucoid zygotes »
Development.(2000) 127 : 1651-1660. -
Corellou F., Brownlee C., Kloareg B. and Bouget F.Y.
« Cell cycle-dependent control of polarised development by a cyclin-dependent kinase-like protein in the Fucus zygote »
Development. (2001) 128:4383-4392. -
Delaroque, N., Müller, D. G., Bothe, G., Pohl, T., Knippers, R. and Boland, W.
« The complete DNA sequence of the Ectocarpus siliculosus virus EsV-1 genome »
Virology. (2001) 287:112-132. -
Draisma, S. G. A., Peters, A. F. and Fletcher, R. L.
« Evolution and taxonomy in the Phaeophyceae : effects of the molecular age on brown algal systematics »
Norton, T. A. [Ed.] Out of the Past. Collected reviews to celebrate the jubilee of the British Phycological Society. The British Phycological Society, Belfast. (2003) pp. 87-102. -
Maier, I., Parodi, E., Westermeier, R., Muller, D.G.
« Maullinia ectocarpii gen. et sp. nov. (Plasmodiophorea), an intracellular parasite in Ectocarpus siliculosus (Ectocarpales, Phaeophyceae) and other filamentous brown algae »
Protist. (2000) 151, 225-238. -
Müller D.G., Kapp M. and Knippers R.
« Viruses in marine brown algae »
Adv. Virus Res.(1998) 50:49-67. -
Nagasato, C. and Motomura, T.
« Influence of the centrosome in cytokinesis of brown algae : polyspermic zygotes of Scytosiphon lomentaria (Scytosiphonales, Phaeophyceae) »
J. Cell Science (2002) 115 : 2541-2548. -
Peters, A.F., Marie, D., Scornet, D., Kloareg, B. and Cock, J.M.
« Proposal of Ectocarpus siliculosus as a model organism for brown algal genetics and genomics »
Journal of Phycology. (2004) 40, 1079-1088. -
Peters, A.F., Scornet, D., Müller, D.G., Kloareg, B. and Cock, J.M.
« Inheritance of organelles in artificial hybrids of the isogamous multicellular chromist alga Ectocarpus siliculosus (Phaeophyceae) »
Eur. J. Phycol.(2004) 39, 235-242. -
Potin P., Bouarab K., Salaün J.-P., Pohnert G., Kloareg B.
« Biotic interactions of marine algae »
Curr. Op. Plant Biol.(2002) 5 : 308-317. -
McHugh, D. J.
« A guide to the seaweed industry »
FAO Fisheries Technical Paper(2003) No. 441. FAO, Rome, 105 pp. -
Yoon, H.S., Hackett, J.D., Pinto, G., Bhattacharya, D.
« The single, ancient origin of chromist plastids »
Proc. Natl. Acad. Sci., USA.(2002) 99 : 15507-15512