Les analyses ont été réalisées sur un nano-hybride, un système
biologiquement actif en l’absence d’eau et composé d’une protéine, la
myoglobine[3], entourée d’une couche de polymères. Les
chercheurs ont étudié séparément la dynamique de chacun des constituants
et ont montré comment ces polymères peuvent remplacer l’eau pour
lubrifier la protéine et lui permettre des mouvements essentiels à son
fonctionnement.
Ces résultats pourraient ouvrir de
nouveaux champs d’applications dans l’industrie, en pharmacologie et en
médecine. Ils sont publiés en ligne le 2 août par le Journal of the American Chemical Society.
Indispensables
à la vie des cellules, les protéines actives sont de véritables
machines moléculaires. Elles peuvent accélérer la vitesse de réactions
chimiques, soutenir les tissus, stocker et transporter des substances
essentielles, assurer la communication entre cellules et défendre
l’organisme contre les corps étrangers. Les protéines possèdent en
grande majorité une structure tridimensionnelle bien définie et des
mouvements intrinsèques appropriés nécessaires à leur fonctionnement
biologique. Certains facteurs comme la déshydratation cellulaire, ou
encore le changement brutal de température, peuvent entraîner une
inactivation des protéines : elles ne sont alors plus fonctionnelles et
peuvent mener, à terme, à la mort cellulaire.
Il était admis
qu’une protéine ne pouvait être fonctionnelle en l’absence d’eau dans
son environnement. En 2010, une équipe anglaise de l’Université de
Bristol a réussi à créer un nano-hybride, constitué d’une protéine, la
myoglobine, encapsulée par des polymères. Ces derniers ont créé une
couche autour de la protéine, d’où l’eau était totalement absente, tout
en la maintenant fonctionnelle. Cependant, la raison pour laquelle les
polymères permettaient de conserver la fonction biologique intacte de la
protéine restait un mystère.
Une équipe internationale impliquant
des chercheurs du CEA, du CNRS, de l’Université Joseph-Fourier, de
l’Université de Bristol (Royaume-Uni), de l’Université Nationale
Australienne et du Forschungszentrum Jülich (Allemagne), a
alors étudié la dynamique de ce nano-hybride par diffusion de neutrons
produits par un réacteur nucléaire de recherche[4]. De manière à
analyser séparément la myoglobine et la couche de polymères sans altérer
l’intégrité du système, l’équipe a eu recours à une astuce. Ils ont
marqué la protéine avec du deutérium (un isotope de l’hydrogène)[5]. Une
fois marquée, la myoglobine devient invisible[6] « aux yeux » des
neutrons, permettant ainsi d’observer uniquement la dynamique de la
couche de polymères. Inversement, l’utilisation de polymères marqués au
deutérium permet de n’observer que la dynamique de la myoglobine.
Grâce
à la combinaison des techniques de marquage isotopique et de diffusion
de neutrons, les chercheurs ont pour la première fois pu montrer que ces
polymères possèdent une dynamique équivalente à celle des molécules
d’eau autour des protéines. D’autre part, ils ont montré que la
myoglobine présente dans le nano-hybride possède une dynamique similaire
à celle d’une protéine qui serait normalement hydratée. Au sein de ce
système, la myoglobine reste donc fonctionnelle malgré l’absence d’eau :
les polymères jouent ainsi le rôle de lubrifiant pour les mouvements de
la protéine, mission normalement remplie par les molécules d’eau dans
un environnement physiologique.
[1] L'Institut de Biologie Structurale (CEA/CNRS/Université Joseph-Fourier).
[2] L’Institut Laue-Langevin (Grenoble).
[3] Protéine impliquée dans le stockage de l’oxygène dans les muscles.
[4] Deux réacteurs ont été utilisés ici : le réacteur de recherche à haut flux localisé au sein de l'Institut Laue-Langevin (ILL) à Grenoble (France) et le réacteur de recherche FRM II à Garching, près de Munich (Allemagne).
[5] Préparation effectuée au laboratoire de deutération de l’Institut Laue-Langevin.
[6] Du fait de ses propriétés particulières, le deutérium affaiblit le signal mesuré quand il remplace l'hydrogène, jusqu’à le « masquer ».
Rendre des protéines
fonctionnelles en l’absence d’eau pourrait ouvrir un champ de travail
dans plusieurs secteurs industriels. En effet, la présence d’eau reste
un handicap dans bien des situations, comme la conservation de solutions
de protéines (dégradation) ou la création de médicaments à forte
concentration en principe actif (agrégation). A terme, il serait
possible de manipuler facilement un très grand nombre de protéines
nécessaires au développement d’applications dans l’industrie, en
pharmacologie, et en médecine.
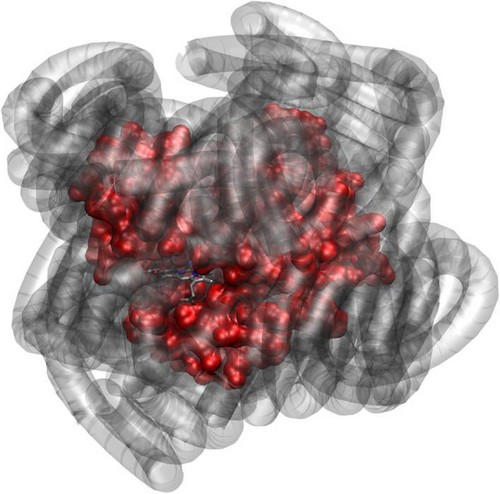
Malgré l’absence d’eau dans son environnement, la myoglobine (en rouge), enrobée d’une couche de polymères particuliers (en gris) conserve sa fonctionnalité biologique. © Journal of the American Chemical Society.