A première vue, le Service hospitalier Frédéric Joliot (SHFJ) ressemble à n’importe quel service hospitalier. On y croise des médecins et infirmiers qui s’affairent dans les couloirs ainsi que des patients venus y effectuer des examens en imagerie. Si le décor nous semble familier, le SHFJ n’a pourtant rien d’un hôpital ordinaire. Il est en effet non seulement un service médical, mais aussi
un centre reconnu de recherche en imagerie, doté d’équipements de pointe que l’on ne trouve nulle part ailleurs en Ile-de-France.
Les équipes du SHFJ que nous rencontrons ce matin sont ainsi à la fois mobilisées auprès des patients pour des examens courants, tout en œuvrant également pour faire avancer la recherche, principalement
en oncologie et sur les maladies neurodégénératives. Elles possèdent pour cela une expertise unique :
la production et l’injection de radiotraceurs permettant de détecter, lors d’un examen d’imagerie médicale de haute technologie, la
Tomographie par Emission de
Positons (TEP), les marqueurs caractéristiques de ces pathologies. Objectif : accumuler des connaissances afin d’améliorer in fine les diagnostics, les suivis de leurs manifestations et de leurs évolutions, voire les traitements.
Un savoir-faire historique
«
Pour fabriquer un radiotraceur, on prend une molécule, sur laquelle on va greffer un noyau radioactif, du fluor 18 ou du carbone 11, qui émet des positons. On va le détecter ensuite via une caméra TEP constituée d’une couronne de détecteurs qui balaye le corps du patient pour visualiser les endroits où le radiotraceur se fixe. Cela permet de faire des cartographies très détaillées de pathologies, notamment les cancers, qu’aucune autre technique d’imagerie ne permet de réaliser », présente Vincent Lebon, chef du SHFJ. Et ce de façon non invasive : une micro-dose suffit pour que la TEP repère le radiotraceur.
Ce savoir-faire, le SHFJ le maîtrise depuis des décennies. «
A l’origine de ce service, adossé dès ses débuts à l’hôpital, il y a le rêve de Frédéric Joliot et d’Irène Joliot-Curie, celui de voir le corps humain en transparence grâce à l’administration de radioéléments artificiels, explique, enthousiaste, Vincent Lebon.
Une intuition pionnière et visionnaire, 80 ans avant la généralisation de la TEP à l’hôpital ».
Une production « maison » au service de la médecine de précision
Le SHFJ est le seul service hospitalier en Ile-de-France à disposer d’outils et d’équipements permettant de fabriquer des radiotraceurs sur place. «
Ce qui fait que nous produisons et livrons également des radiotraceurs pour plusieurs protocoles de recherche d’hôpitaux franciliens, comme la Pitié- Salpêtrière », ajoute Vincent Lebon.
Cette technologie très puissante qu’est la TEP ouvre par ailleurs la voie à des explorations du corps humain beaucoup plus fines, avec une production de radiotraceurs adaptés aux besoins de chaque maladie à étudier. «
Tout l’enjeu de la recherche que l’on mène au SHFJ, autour de l’imagerie istotopique, est d’arriver à une médecine de précision », insiste Vincent Lebon.
Les recherches conduites au SHFJ sur la maladie d’Alzheimer
La maladie d’Alzheimer est la première cause de dépendance lourde en France chez les personnes âgées et représente 70 % des maladies neurodégénératives diagnostiquées chez ces personnes*. Elle n’est à ce jour pas curable. Mobilisé depuis une dizaine d’années autour de cette pathologie, le SHFJ conduit actuellement 3 essais cliniques visant à mieux la comprendre, la prédire et la traiter, en collaboration avec le GHU Psychiatrie & Neurosciences de l’hôpital Sainte Anne à Paris.
«
L’une des caractéristiques de la maladie d’Alzheimer est
l’accumulation de protéines anormales dans le cerveau, les protéines amyloïde et Tau, que l’on peut détecter in vivo en TEP depuis quelques années seulement. Nous étudions les processus physiopathologiques, la topographie de ces protéines anormales, leurs interactions, ainsi que le lien entre
tauopathie et neurodégénérescence. Nous étudions aussi des processus qui pourraient être modulateurs, comme par exemple la
neuroinflammation qu’on peut visualiser en TEP à l’aide d’autres radiotraceurs », explique Julien Lagarde, neurologue clinicien et chercheur dans l’unité de recherche BioMaps du SHFJ, qui coordonne ces études avec la neurologue Marie Sarazin et le docteur Michel Bottlaender.
Ces recherches, combinées avec celles menées par
NeuroSpin, centre de recherche en imagerie cérébrale du CEA doté d’IRM très puissants, ont pour but d’améliorer la qualité des essais thérapeutiques grâce à des diagnostics plus précis et plus précoces. L’objectif du SHFJ est également de contribuer au développement de marqueurs permettant d’affiner plus encore les outils dont on dispose pour diagnostiquer in vivo la maladie, en s’approchant au plus près de ce qui se passe dans le cerveau du patient. C’est le radiotraceur [18F]-flortaucipir (anciennement appelé AV-1451), spécifique des agrégats de protéine tau, qui permet de détecter la tauopathie caractéristique de certaines maladies neurodégénératives. « Le SHFJ contribue à valider ce traceur comme un biomarqueur de la maladie d’Alzheimer, ainsi que d'autres radiotraceurs ciblant d'autres processus impliqués dans ces maladies, comme la neuroinflammation », précise Julien Lagarde.
Le cyclotron : le début d’une course contre la montre pour fabriquer les radiotraceurs
Pour comprendre comment sont fabriqués ces radiotraceurs, revenons au tout début de l’histoire,
au moment où les noyaux radioactifs sont produits. Pour cela, il faut se rendre jusqu’au cyclotron médical du SHFJ. « Le cyclotron permet d’accélérer des particules électriquement chargées afin de provoquer une réaction de transmutation nucléaire. Par exemple, un proton accéléré à une énergie de 18 MeV va percuter le noyau d’un atome d’oxygène 18O, ce qui va créer du fluor 18F utilisé pour l’imagerie TEP », indique Julien Varin, ingénieur en charge de piloter ce mastodonte de 22 tonnes. Le cyclotron impressionne, tant il est massif. On n’aurait jamais pensé rencontrer un tel dispositif ailleurs que sur un site industriel. « Le
premier cyclotron médical français a été installé ici dans les années 1970 » nous dit pourtant Vincent Lebon.

Cyclotron IBA du Service Hospitalier Frédéric Joliot. © P.Stroppa / CEA
Le cyclotron est installé dans un bâtiment possédant des murs en béton très épais, d’1 mètre 20, afin de stopper les neutrons générés par la réaction nucléaire. Il est utilisé 5 à 6 fois par jour, tous les jours de la semaine sauf le lundi, pour sa maintenance.
Une fois que l’on a produit suffisamment de fluor 18 ou de carbone 11, soit après 30 minutes voire une heure d’irradiation, celui-ci va sortir du cyclotron et traverser le bâtiment via des goulottes plombées, afin de protéger des rayonnements ionisants les personnels et les installations. Les noyaux radioactifs vont ainsi rejoindre des
enceintes blindées, situées sur la
plateforme de radiopharmacie, afin d’y être transformés en radiotraceur injectable.
Dès que les noyaux radioactifs quittent le cyclotron, il n’y a plus une minute à perdre. Ils ont en effet une
demi-vie très courte. Au bout de 2h, notre radiotraceur à base de fluor 18 aura déjà perdu la moitié de son activité. Pour le carbone 11, ce sera au bout de 20 minutes. C’est donc à chaque fois une course contre la montre pour produire les radiotraceurs. «
Le matin, on a tous des chronomètres autour du cou et on se synchronise sur le cyclotron », indique Antoine Pinon, radiopharmacien.
La production du radiotraceur en radiopharmacie : une étape ultra-contrôlée
Le noyau radioactif étant produit, il faut maintenant l’accrocher à son vecteur (une molécule d’intérêt biologique), pour fabriquer le radiotraceur. La fixation se fait via une combinaison de réactions chimiques en un délai très court. «
Cette combinaison a lieu dans une enceinte blindée où arrive le noyau radioactif. Elle est effectuée par des automates de synthèse, contrôlés depuis l’extérieur par un ordinateur, pour nous protéger de tout risque d’irradiation », explique Antoine Pinon.

Chaine de fabrication de préparations radiopharmaceutiques du Service Hospitalier Frédéric Joliot (plateforme CaOr – Carbone Orsay). © F. Rhodes / CEA
La synthèse du radiotraceur s’effectue en salle blanche, dans la radiopharmacie CaOR (Carbone Orsay) du SHFJ, dotée d’une succession de postes de synthèse et de contrôle-qualité. Pour que le radiotraceur puisse être administré au patient, le radiopharmacien doit s’assurer qu’il réponde à des normes de sécurité et d’hygiène élevées. Un contrôle qualité strict permet de garantir que l’examen d’imagerie médicale produira des images optimales. «
Notre appartenance au CEA offre une garantie de respect très strict des réglementations. Le SHFJ n’a pas fermé une seule semaine depuis sa création pour des problématiques d’autorisation », souligne Antoine Pinon.
Jusqu’à huit synthèses destinées aux patients peuvent être produites par semaine avec un planning établi à l’avance, selon les demandes des hôpitaux environnants et les besoins du SHFJ.
La radiochimie pour développer les molécules et tester les radiotraceurs
Quand on veut développer un nouveau radiotraceur, il y a un important travail de recherche amont effectué par les radiochimistes du SHFJ pour concevoir et préparer la molécule sur laquelle on va fixer le noyau radioactif.
Les radiochimistes ont aussi pour rôle de tester et caractériser la combinaison de réactions chimiques visant à fabriquer le radiotraceur. Ils vont ainsi élaborer un processus de radiosynthèse, avec la quantité de réactifs nécessaire pour une fabrication optimale.
Une fois le radiotraceur fabriqué, il va être testé lors d’essais précliniques sur des
modèles animaux. Il faut en effet vérifier que le produit se fixe bien, que l’on peut le détecter en imagerie et qu’il peut être un bon candidat pour des essais cliniques sur l’homme.
«
Nous faisons également en parallèle de la caractérisation chimique avec une molécule identique à celle testée, mais non radioactive. Nous convergeons ensuite l’ensemble de nos démarches », ajoute Mylène Richard, ingénieur-chercheur. « Lorsque le processus est validé, consolidé et reproductible, ce qui peut prendre des années de recherches, on peut le transférer en radiopharmacie », conclut Mylène Richard.
Tous les éléments visant à préparer le radiotraceur sont préparés la veille pour le lendemain sur les automates. Il n’y a plus qu’à ajouter l’atome radioactif le jour de la fabrication. Au terme de plusieurs réactions chimiques, place à la phase de purification du radiotraceur dans une autre enceinte blindée et stérile où tout est manipulé à distance, via des pinces, pour protéger le personnel de la radioactivité. Il faut ensuite conditionner le produit fini dans une seringue disposée dans un container blindé, avant de l’administrer au patient.

Boîte à pinces du laboratoire de production de la chaine CaOr. © F. Rhodes / CEA
Acquisition, traitement et reconstruction des images au service des essais cliniques
Ce sont Elizabeth Mendes et Bérangère Eyl, manipulatrices radio, qui se chargent aujourd’hui d’accueillir le patient et de lui administrer par voie intraveineuse le radiotraceur qui vient d’être fabriqué. Elles doivent ensuite gérer l’acquisition des images sur une caméra TEP de recherche en neurologie, acquisition qui peut parfois être très longue, jusqu’à 1h30. «
Nous avons un rôle de soignant. Nous tâchons de mettre le patient à l’aise, nous l’informons de la durée de l’examen, de toutes les contrindications, explique Elizabeth Mendes. Nous devons également nous assurer de la sécurité des patients et de la nôtre. Nous transportons la seringue dans le container blindé selon un protocole strict de radioprotection, avant de l’injecter. » Les manipulatrices radio préparent aussi la salle d’examen et les instruments, vérifiant notamment les réglages. «
Nous devons maîtriser parfaitement les équipements avec lesquels nous travaillons, respecter les protocoles spécifiques pour chaque type d’examen, être très précises et rigoureuses », ajoute Bérangère Eyl. Les manipulatrices radio vérifient aussi que les images sont correctement acquises pour leur traitement ultérieur.
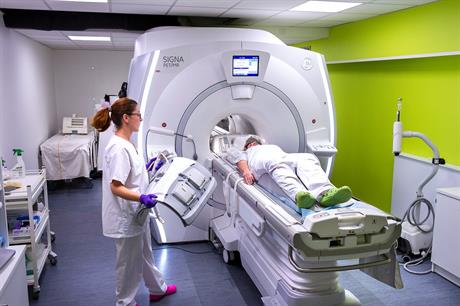
Réalisation d'un examen d'imagerie TEP / IRM au SHFJ © L. Godart / CEA
Quand les données sont enregistrées, il faut reconstruire et traiter les images afin de fournir les informations les plus pertinentes et de la plus grande qualité possible aux chercheurs. «
Nous estimons la distribution spatiale du radiotraceur pendant l’examen, et dans le cas d’études dynamiques son évolution au cours du temps voire directement des paramètres physiologiques » explique Florent Sureau, ingénieur-chercheur en reconstruction d’images. Pour ce faire, les chercheurs s’appuient sur des modèles physiques et des modèles prenant en compte les processus physiopathologiques qui ont eu lieu pendant l’acquisition, par exemple, pour la maladie d’Alzheimer, l’accumulation de la protéine Tau. Florent Sureau : «
Avec ces modèles et l’intelligence artificielle, nous pouvons améliorer la précision dans l’estimation des paramètres, en apportant des informations adaptées au protocole considéré. » Le travail de reconstruction et de traitement des images doit être effectué pour chaque nouvelle molécule. «
Chaque traceur est modélisé d’une manière qui lui est propre. C’est à réinventer à chaque fois qu’on développe un nouveau radiotraceur », complète Florent Sureau.

Interprétation des images médicales par les médecins nucléaires du SHFJ © L. Godart / CEA
L’image acquise pour chaque sujet est reconstruite et traitée puis analysée et comparée entre les différents groupes de sujets inclus dans le protocole. «
Nous travaillons sur ces images dynamiques reconstruites qui vont nous permettre de quantifier la fixation du traceur dans les différentes régions du cerveau, explique Julien Lagarde. Nous effectuons ensuite des comparaisons avec des images acquises sur des volontaires sains, servant de référence ou des corrélations avec différentes variables cliniques, morphologiques ou biologiques.»
Cette démarche pluridisciplinaire, avec des équipes aux compétences à la fois pointues et variées, est la véritable force du SHFJ. «
Des neurologues aux physiciens en passant par les infirmiers, les manipulateurs radio, les radiochimistes et les radiopharmaciens, tout le monde au SHFJ travaille main dans la main. Avec pour seul but d’apporter aux médecins les outils les plus performants qui soient pour qu’ils puissent mener leurs recherches avec succès, au bénéfice des patients et de la société », conclut Vincent Lebon. Cette dimension multidisciplinaire sera renforcée avec le déménagement du SHFJ sur le plateau de Saclay en 2026, dans le cadre du
projet PASREL. Les équipes du SHFJ seront alors adossées au futur hôpital de Saclay, au cœur d’un gigantesque écosystème de recherche comprenant des établissements de santé, des laboratoires et des industriels. Avec à la clé, la possibilité pour le SHFJ de poursuivre son illustre parcours en déployant et en transférant son expertise en imagerie médicale pour les futures technologies au service de la santé.