Pourriez-vous nous expliquer ce qu’on entend par biomédicament et bioproduction ?
Bernard Maillère : Les biomédicaments sont une gamme de médicaments dont la particularité est d’être
produits à partir d’une source biologique vivante telles que des cellules ou bactéries. Une grande partie de ces biomédicaments sont des protéines dites « recombinantes », car produites par un micro-organisme dans lequel un gène étranger (en l’occurrence humain), permettant de fabriquer la protéine d’intérêt a été introduit.
© Pixabay
On retrouve des biomédicaments dans différentes classes de produits pharmaceutiques, comme
les vaccins, les protéines recombinantes, les hormones ou encore les
anticorps monoclonaux. Les biomédicaments concernent aussi des produits de
thérapies innovantes,
comme la thérapie génique qui consiste à introduire du matériel génétique dans des cellules ou tissus du patient pour traiter une maladie, la
thérapie cellulaire (transplantation de cellules saines à un patient afin de remplacer des cellules malades) ou encore
la thérapie tissulaire (greffes de tissus vivants).
La bioproduction regroupe
l’ensemble des procédés et biotechnologies permettant de produire ces biomédicaments.
Aujourd’hui, même si la majeure partie des médicaments produits restent issus de l’industrie pharmaceutique chimique,
un médicament sur deux en développement dans le monde est un biomédicament.
Biothérapies et bioproduction en France
- La France importe 95 % de biomédicaments.
- La France est le 4e producteur européen de biomédicaments derrière l’Allemagne, l’Italie et la Suisse.
- Sur les 76 biothérapies commercialisées en Europe, 5 biothérapies sont produites en France, contre 21 en Allemagne et 12 en Italie.
- Un médicament sur deux en développement est un biomédicament.
- Il existe seulement 18 producteurs de lots commerciaux sur tout le territoire français.
Quelles pathologies sont traitées par les biomédicaments et quels sont les bénéfices de ces biothérapies ?
Bernard Maillère : Les biomédicaments sont utilisés principalement pour traiter les cancers, les maladies inflammatoires, les maladies auto-immunes, les maladies infectieuses, les déficiences génétiques et hormonales (hémophilie, diabètes). Ces traitements constituent ainsi
un enjeu de santé publique majeur, beaucoup de patients pouvant être traités par les biothérapies.
© Adobestock
C’est aussi une véritable révolution médicale : en prenant pour cible un type de cellule précis, les biothérapies s’inscrivent dans la quête de
la médecine personnalisée et dans celle des
thérapies ciblées. Par exemple, pour traiter le cancer, la chimiothérapie agit sur tout le corps afin d’empêcher les cellules cancéreuses de proliférer, avec pour conséquence beaucoup d’effets secondaires. Tandis qu’une biothérapie, à base d’anticorps thérapeutiques, va agir uniquement au niveau de la tumeur, avec des effets plus ciblés et donc moins d’effets secondaires. La thérapie peut être même personnalisée en fonction du profil génétique du patient.
De plus, pour certaines thérapies, comme la thérapie tissulaire, il n’existe pas d’équivalent chimique au biomédicament. On ne peut pas faire un tissu de peau chimique par exemple, c’est trop compliqué.
Pouvez-vous nous en dire plus sur la bioproduction, soit la fabrication de ces biomédicaments ?
Nadège Nief : La bioproduction obéit à des procédés et réglementations très stricts. C’est dans un milieu confiné,
au sein d’un bioréacteur, que l’on fait d’abord
croître des cellules vivantes afin qu’elles synthétisent le produit voulu, par exemple une protéine d’intérêt. Objectif in fine : avoir la plus grande quantité de produit fini par litre. Pour ce faire, on leur apporte un bon milieu de culture en contrôlant les paramètres critiques (température,
métabolites, gaz dissous, viabilité cellulaire, etc.) et les composants qu’il y a dans ce milieu et en maintenant à tout prix un environnement stérile. Une fois cette étape de croissance cellulaire terminée, place à la phase de récolte, puis de purification, de filtration et d’inactivation et de filtration virale pour réussir à isoler la protéine d’intérêt.
Combien de temps durent ces procédés de bioproduction ?
Nadège Nief : La
bioproduction peut durer de 5 à 21 jours voire plus, selon le type de cellule et de biomédicament à produire. De nombreux contrôles qualité ont lieu en cours de bioproduction et à l’issue de celle-ci, ce qui là aussi prend beaucoup de temps. Alors que dans des processus chimiques, les procédés sont plus courts et maîtrisés, permettant des rendements de production assez élevés, quand on a recours au biologique,
les processus sont plus variables, complexes et difficiles à paramétrer. La production se fait donc avec des rendements plus modestes, hormis pour les anticorps, sur lesquels nous avons 20 ans d’expérience, ce qui nous a permis d’améliorer nettement les rendements.
Comment peut-on augmenter l’efficience de la bioproduction ?
Nadège Nief : Idéalement, pour réduire le temps de production et augmenter les rendements, il faudrait pouvoir arriver à un système où
tout est automatisé et autorégulé, en jouant sur les procédés en eux-mêmes mais aussi en ajoutant des automates, de l’intelligence artificielle (IA) et des capteurs. Pour quelques biomédicaments existants et assez matures comme certains anticorps, nous sommes déjà dans la phase d’optimisation et le suivi des procédés via l’intégration de l’IA et de capteurs,
projets auxquels contribue le CEA, tant sur la partie production, qu’en amont sur la façon dont les anticorps sont générés. Pour ce qui est des thérapies plus récentes, comme les thérapies cellulaires et tissulaires, il faut encore optimiser en profondeur les procédés, voire les développer pour certains.
Pourriez-vous nous en dire plus sur les projets auxquels contribue le CEA pour optimiser les procédés de bioproduction ?
Nadège Nief : Le CEA dispose d’expertises internationalement reconnues en bio-ingénierie et en micro et nanotechnologies et plus largement en technologies innovantes pour la santé, mises à profit depuis plusieurs années dans le domaine de l’optimisation de la production de biomédicaments. Le CEA apporte ainsi aux industriels son savoir-faire technologique dans le cadre de plusieurs projets, afin de leur apporter à terme
un gain de compétitivité et d’efficacité.
Parmi les projets lancés récemment en 2021, nous contribuons au
projet CALIPSO avec SANOFI, Capgemini Altran, centrale supélec, GPC, bio, Ypso facto, qui vise à développer de nouveaux capteurs et systèmes innovants pour optimiser les bioprocédés actuels. Nous faisons également partie du projet SELPHI, avec Servier, Sanofi, Iprasense et l’intégrateur MTInov, dont le but est de développer un outil optique permettant de suivre la viabilité de la cellule et même de détecter précocement sa mort cellulaire programmée. Nous avons aussi lancé récemment un projet de développement technologique de vaccins ARN de nouvelle génération avec l’industriel CEVA.
Nous sommes également mobilisés sur
un projet d’organoïdes thérapeutiques, petits amas cellulaires thérapeutiques qui peuvent être utilisés pour la thérapie cellulaire. Par exemple, on peut imaginer injecter des amas de cellules pancréatiques à des personnes dont les îlots pancréatiques ont été détruits, et ce, pour pallier le diabète de type 1 notamment. Pour ce faire, les cellules du patient à traiter sont prélevées, on les fait croître via les procédés de bioproduction et on les réinjecte au patient.
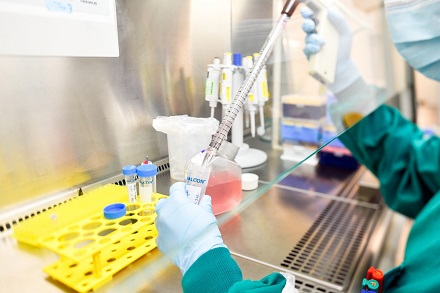
Passage de cellules pancréatiques humaines (lignée cellulaire). Les cellules doivent régulièrement subir une dilution (un passage) afin de continuer à se multiplier et à se développer correctement. © A. Aubert / CEA
Bernard Maillère : Le CEA travaille également sur
des aspects en amont à la bioproduction tels que l’optimisation des biomédicaments. Il est en effet très important pour que la production ait lieu dans de bonnes conditions que l’anticorps soit synthétisé par la cellule avec un bon rendement, soit stable et n’induise pas de réponses immunitaires indésirables.
Nous participons également à des programmes européens dans ce domaine, auxquels sont associées de nombreuses entreprises pharmaceutiques. Le
projet ABIRISK a ainsi regroupé 39 partenaires autour de l’immunogénicité des protéines thérapeutiques. Nous participons à un
projet de taille équivalente (ARDAT) qui porte sur l’immunogénicité des thérapies géniques et cellulaires. Nous possédons également une forte expérience dans la fabrication d’anticorps pour le diagnostic. Ce qui nous a amené à développer, en collaboration avec NG Biotech et dans le cadre de l’AMI « maladies infectieuses émergentes et menaces NRBC » notre propre laboratoire de bioproduction.
Quels sont les enjeux et les défis de la bioproduction en France ?
Nadège Nief : Cela fait plus de dix ans que la France connait des
périodes de ruptures d’approvisionnement, dans des hôpitaux et pharmacies qui ne reçoivent pas les médicaments dont ils ont besoin. Cela concerne notamment les biomédicaments. La France est devenue
très dépendante d’autres pays pour ses approvisionnements en biomédicaments. Par exemple, 97% des anticorps monoclonaux prescrits en France sont produits à l’étranger. Notre pays ne s’est pas industrialisé assez vite sur le sujet et produit peu à ce jour, les coûts de bioproduction sont encore parfois très élevés, tant les procédés sont longs et complexes. Un autre enjeu, en plus des capacités de production efficientes, est l’accès aux équipements, consommables et matière premières nécessaires à la bioproduction (milieu de culture des cellules, résines utilisées pour l’étape de purification des bioprocédés, poches, filtres, etc.), dont la production en Europe n’est pas en quantité suffisante pour couvrir la forte demande actuelle liée notamment à la fabrication de vaccins.
Il s’agit donc d’un véritable enjeu de souveraineté, d’indépendance sanitaire et de compétitivité que d’accélérer l’industrialisation française en bioproduction. C’est pourquoi l’Etat investit massivement dans cette filière industrielle de bioproduction, comme annoncé dans le cadre du
plan France 2030. Avec notamment
un programme et équipement prioritaire de recherche ( PEPR ), annoncé le 7 janvier dernier, doté de 80 millions d’€ et co-piloté par l’INSERM et le CEA.
Bernard Maillère : Pour attirer les industriels, il faut qu'il y ait un environnement académique de qualité et qui les concerne. Ce PEPR est aussi l'occasion de créer cet environnement, en réunissant et en mobilisant une grande partie des acteurs du domaine. Nous avons en France
une recherche d’excellence dans la compréhension des mécanismes du vivant et la recherche de molécules et de biomédicaments innovants. Il s’agit désormais de nous mettre en ordre de bataille pour développer et mettre en valeur des activités de recherche technologique qui contribueront à faire de la France un leader en biothérapies et bioproduction.
Nadège Nief : Côté CEA, nous avons à la fois cet
apport académique de haut niveau et cette proximité avec les industriels et les technologies innovantes. Nous avons un positionnement assez différenciant, offrant un large panel d’expertises.
Présidence française du Conseil de l'Union européenne
Nadège Nief interviendra lors de
la conférence ministérielle organisée le 3 mars 2022, dans le cadre de la présidence française du Conseil de l’Union européenne sur « Pour une Europe de la santé indépendante, compétitive et innovante ».
Bernard Maillère est chef du laboratoire d’Immunologie cellulaire et Biotechnologie au Département Médicaments et Technologies de l'Institut des sciences du vivant Frédéric Joliot du CEA.
Nadège Nief est directrice adjointe du département des microtechnologies pour la santé au CEA-Leti.