Origine et destin des noyaux atomiques
La matière que nous connaissons constitue 5 % du contenu total de l’Univers. La plupart des atomes qui le composent (hydrogène, hélium et un peu de lithium) ont été formés dans ses premiers instants. C’est ce que l’on appelle la nucléosynthèse primordiale. Tous les noyaux atomiques stables ont été formés au cœur des étoiles par la réaction de fusion nucléaire qui conduit des noyaux légers à fusionner et former des noyaux plus lourds.
Au cours de leur existence, les étoiles créent ainsi des noyaux pouvant avoir jusqu’à 26 protons, c’est-à-dire des noyaux d’atomes de fer. A la fin de leur évolution, les étoiles les plus massives explosent en supernova. L’énergie considérable de cette explosion permet de synthétiser de nombreux noyaux plus lourds. Ceux qui sont stables, ou qui ont une très longue période radioactive, se retrouvent dans les nuages de gaz et de poussière à partir desquels de nouvelles étoiles se forment.
Ainsi, la Terre est composée de 32,1 % de fer, 30,1 % d’oxygène, 15,1 % de silicium, 3,9 % de magnésium, et de tous les autres éléments en proportions inférieures. Elle renferme aussi des isotopes instables (radioactifs) dont la désintégration régulière est à l’origine de son état thermique interne : potassium 40, uranium 238 et thorium 232 principalement.
Représentation du nuage électronique de l'atome de Lithium
L’atome de lithium représenté a trois protons, quatre neutrons et trois électrons.
On ne peut pas donner la position exacte des trois électrons dans le «nuage électronique». Dans cette représentation, les électrons se trouvent, de façon plus probable, dans les zones les plus foncées. Cette image est le résultat de formules mathématiques.
Représentation du nuage électronique de l'atome de Lithium -
© Yuvanoe/CEA
Tous les corps sont constitués d’assemblages d’atomes.
De gauche à droite : métal, cristal et polymère.

© P. Avavian/CEA
| 
© MNHN
| 
© CEA
|
Qu'est ce qu'un atome ?
Bien qu’il soit probable qu’une proportion importante de la masse de l’Univers soit de nature inconnue (matière noire),
la matière qui nous est familière est constituée d’atomes. Les multiples modes d’assemblage de ces atomes les uns avec les autres produisent l’immense diversité matérielle des molécules, macromolécules, polymères, cristaux, métaux, nanomatériaux…
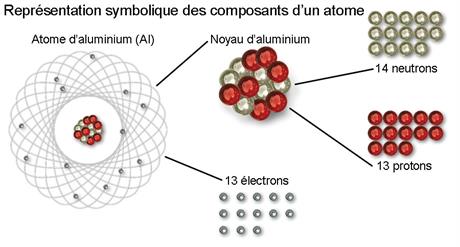
Trois briques composent les atomes : les protons, les neutrons et les électrons.
-
Le noyau central est un assemblage de protons et de neutrons. Les
protons et les
neutrons constituent les nucléons (du mot latin “nucleus” signifiant noyau).
- Chargés négativement, les
électrons (qui appartiennent à la catégorie des fermions) restent à proximité du noyau chargé, lui, positivement. Individuellement, ils ne sont pas vraiment des corpuscules, mais forment un nuage électronique où leurs énergies plus ou moins grandes leur confèrent une agitation plus ou moins intense. Ils sont comme étalés dans l’espace, mais on peut calculer la probabilité de les détecter en tel ou tel endroit.
Ressources multimédia

© Yuvanoé/CEA
Diamètres atomiques et nucléaires
Le diamètre du nuage électronique va de 0,5x10-10 m (hydrogène) à 4,3x10-10 m (radium). C’est très petit : il faudrait « empiler » 1 000 000 d’atomes d’hydrogène pour obtenir le diamètre d’un cheveu !
Longtemps considérés comme inexistants car impossibles à visualiser, les atomes sont devenus une réalité tangible depuis l’invention des microscopes à sonde locale.
Le noyau atomique est beaucoup plus petit. Celui de l’atome d’hydrogène (un unique proton) a un diamètre de 2x10-15 m, celui de l’atome d’uranium est de 2x10-14 m.
Le diamètre du noyau est à peu près 100 000 fois plus petit que celui de l’atome lui-même.
Volume, masse et masse volumique
Les corps solides qui constituent notre environnement courant (métaux, cristaux, polymères) sont constitués d’atomes qui sont attachés les uns aux autres par l’intermédiaire de liaisons assurant leur cohésion. Ainsi, la masse volumique des atomes est voisine de celles de ces corps.
Très petits, les atomes ont à la fois une masse et un volume minuscules. Si l’on prend par exemple une tête d’épingle en fer, d’un volume de 1 mm3, elle est constituée de 60 millions de milliards d’atomes de fer !
Un proton et un neutron ont a peu près la même masse, qui est 1 840 fois plus grande que celle d’un électron, si bien que
le noyau concentre quasiment toute la masse de l’atome. Le diamètre d’un noyau d’atome de fer est de l’ordre de 10-14 m, sa masse vaut 9,3x10-26 kg, la masse volumique de ce noyau est donc de 1,8x1017 kg.m-3, ce qui fait un peu plus de cent milliards de kilogrammes par centimètre cube. Si la tête d’épingle n’était constituée que de noyaux d’atomes de fer, sa masse serait égale à 1,8x108 kg, soit 180 000 tonnes !
Pour estimer la masse d’un noyau, il suffit de connaître son nombre de nucléons. Sachant que la masse d’un nucléon est d’environ 1,67.10-27 kg, il est facile de calculer une masse approximative d’un atome. Cependant, le résultat du calcul n’est qu’une estimation. Mais on sait mesurer directement la masse d’un atome à l’aide d’un spectromètre de masse. Les atomes sont introduits à l’état de vapeur dans une chambre d’ionisation, puis accélérés par un champ électrique. Ils arrivent dans une zone ou règne un champ magnétique qui courbe leur trajectoire. Leur point d’arrivée sur le détecteur est caractéristique de leur masse qui peut ainsi être mesurée précisément.
Charge électrique
La charge électrique positive du proton est exactement l’opposée de celle, négative, de l’électron (le neutron est neutre). Ainsi tout atome, qui possède autant de protons dans son noyau que d’électrons dans son nuage électronique, est électriquement neutre.
Cependant, dans certaines conditions (réactions chimiques…), l’atome peut perdre ou gagner un ou plusieurs électrons et peut alors être chargé positivement ou négativement.
Il est alors appelé ion.
Éléments chimiques et isotopes
Pour un atome donné, le nombre Z de protons, qui est aussi celui des électrons, est son numéro atomique. Le nombre de ses neutrons est noté N. La somme N + Z = A comptabilise donc les nucléons et est appelée nombre de masse.

Spectromètre de masse permettant une mesure isotopique rapide sur un échantillon. © C. Dupont/CEA

Microscope optique en sonde locale. © P. Avavian/CEA
Ces nombres définissent les
éléments chimiques. Chacun est désigné par un symbole (X) et son numéro atomique (ZX) ; par exemple,
1H pour l’hydrogène qui n’a qu’un proton,
26Fe pour le fer qui en a 26. Imaginé en 1869 par Dimitri Mendeleïev afin de classer les atomes en fonction de leur masse et de leurs propriétés chimiques, son tableau a progressivement pris sa forme actuelle.
On trouve sur Terre 94 éléments chimiques naturels.
Tous les atomes d’un élément chimique donné comportent le même nombre de protons (c’est d’ailleurs ce nombre qui définit l’élément chimique). Mais ils peuvent ne pas tous avoir le même nombre de neutrons.
Deux atomes ayant le même nombre de protons et un nombre différent de neutrons sont des isotopes de cet élément.
Par exemple :
- Tous les isotopes de l’hydrogène ont un seul proton mais peuvent avoir zéro, un ou deux neutrons. Ce sont l’hydrogène simple (le plus répandu), le deutérium et le tritium.
- Tous les isotopes du carbone ont 6 protons. Les plus abondants ont 6, 7 ou 8 neutrons.
- Tous les atomes d’uranium ont 92 protons. Deux isotopes existent dans la nature : l’uranium 235 avec 143 neutrons (235 = 92+143) et l’uranium 238 avec 146 neutrons (238 = 92 + 146).
Un isotope est appelé par le nom de son élément chimique associé au nombre total de ses nucléons, ce qui donne par exemple pour le carbone :
12C,
13C et
14C.