RESSOURCE MINIÈRE/ABONDANCE
La croûte terrestre contient en moyenne 2 à 3 grammes d’uranium par tonne. Cet élément est bien plus abondant que les métaux rares comme l’or ou l’argent.
L’eau de mer en contient environ 3,3 milligrammes par tonne.
Dans le sol, il est inégalement réparti mais des mines sont exploitées sur quasiment tous les continents. Les principaux pays disposant de ressources sont l’Australie, le Canada, le Kazakhstan, le Niger, la Namibie, la Russie et l’Afrique du sud.

Source : Uranium 2015, Ressources, Production & Demand (AEN, ed 2015) : réserves raisonnablement assurées accessibles au coût inférieur à 130 dollars US/kg. © CEA
Répartition des principales ressources d’uranium (en millier de tonnes) :
Source : Uranium 2015, Ressources, Production & Demand (AEN, ed 2015) : réserves raisonnablement assurées accessibles au coût inférieur à 130 dollars US/kg. © CEA
ISOTOPIE
Radioactivité
Les isotopes de l’uranium présents à l’état naturel sur la Terre se désintègrent principalement par émission de particules alpha, c’est à dire des rayonnements fortement atténués par un écran aussi mince qu’une feuille de papier. Cependant, leurs descendants radioactifs sont, eux, émetteurs de rayonnements bêta et gamma plus pénétrants.
L'uranium naturel
L’uranium naturel est composé des isotopes 234, 235 et 238. Leurs principales caractéristiques sont les suivantes :
| Composition isotopique de l'uranium naturel
|
Période radioactive (*)
|
U
| 0,0056 %
| 2,46 x 105 an
|
235U
| 0,71 %
| 7,04 x 108 an
|
238U
| 99,28 %
| 4,47 x 109 an
|
(*) période de temps au terme de laquelle la moitié des atomes radioactifs présents initialement s’est désintégrée.
L’isotope 235 de l’uranium est dit « fissile », c’est-à-dire qu’il peut se casser en deux noyaux plus petits, sous l’effet d’un neutron. C’est ce qu’on appelle la fission nucléaire, réaction qui libère une grande quantité d’énergie. L’isotope 238 est dit « fertile » : lorsqu’il est heurté par un neutron, il peut le « capturer », générant du plutonium 239 lui-même fissile.

Composition isotopique de l'uranium naturel © CEA/Idées Fraîches
Autres isotopes
Les chercheurs en physique nucléaire s’intéressent aux noyaux lourds. Riches en neutrons et en protons, ils sont un objet d’étude idéal pour comprendre les lois physiques qui gouvernent ces objets et leurs interactions. Ils ont artificiellement fabriqué, puis caractérisé, plus de 25 isotopes différents de l’uranium. Certaines de ces espèces éminemment fugaces ont des durées de vie extrêmement courtes.
La séparation isotopique
Pour certaines applications, il est nécessaire de modifier la proportion de l’uranium naturel en isotope 235. Ainsi, la plupart des réacteurs nucléaires en fonctionnement dans le monde sont des réacteurs à eau légère qui requièrent un combustible dont la proportion en
235U est comprise entre 3% et 5%. Ceci nécessite donc d’enrichir l’uranium naturel en uranium 235. En France, cette opération de séparation isotopique est réalisée dans l’usine Georges Besse II (voir fiche « L’essentiel sur le cycle du combustible nucléaire »).
Des procédés industriels de séparation isotopique doivent être mis en œuvre. La production d’uranium enrichi s’accompagne alors d’une production d’uranium appauvri.
Comment enrichir l'uranium ?
- Diffusion gazeuse : utilisée industriellement depuis les années 1950 jusqu’au début des années 2010.
- Ultracentrifugation : utilisée aujourd’hui par la plupart des industriels de l’enrichissement.
- Laser : actuellement à l’étude mais pas déployé à l’échelle industrielle.
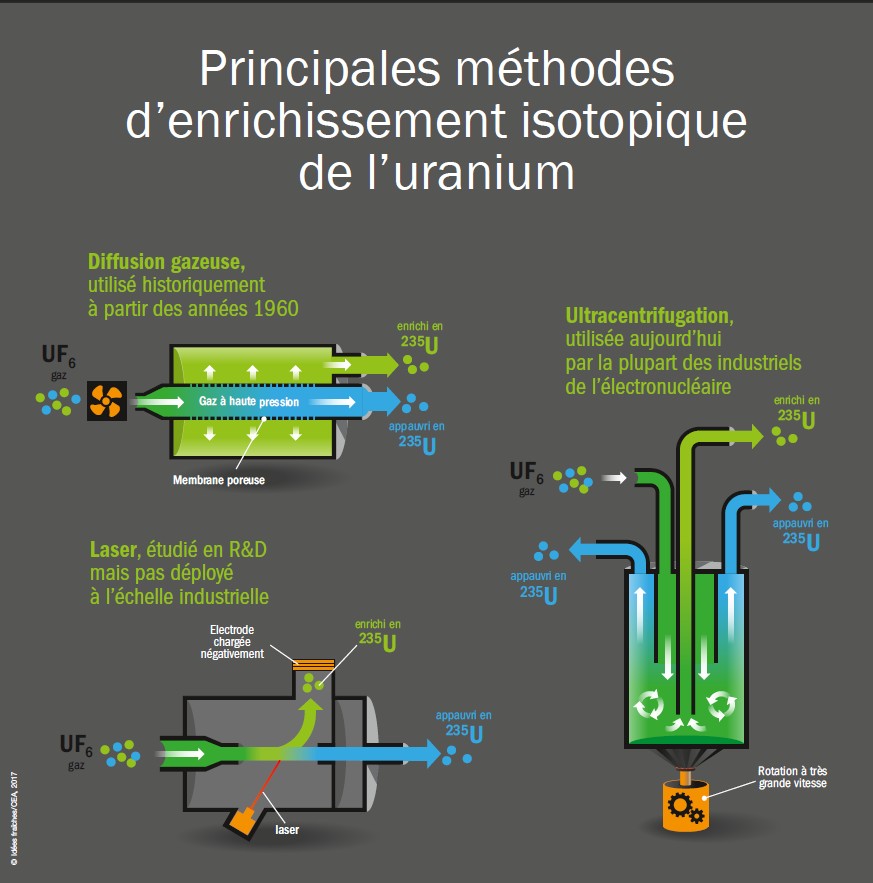
Principales méthodes d'enrichissement d'uranium © CEA/Idées Fraîches
Les différentes catégories de l'uranium
- Uranium naturel (teneur en 235U égale à 0,71 %) : minerai.
- Uranium faiblement enrichi (teneur en 235U supérieure à 0,71 % et strictement inférieure à 20 %) : exploité dans le
secteur électronucléaire
- Uranium hautement enrichi (teneur 235U supérieure ou égale à 20 % : exploité dans les secteurs de la Défense, des réacteurs de recherche et de la médecine nucléaire.
- Uranium appauvri (teneur en 235U inférieure à 0,71 %) : exploité dans les réacteurs à neutrons rapides et dans l’armement conventionnel.
LE CONTRÔLE DE L’USAGE DE L’URANIUM
L’uranium est une matière nucléaire dont la sensibilité dépend de son taux d’enrichissement, dans la mesure où il peut être utilisé tant à des fins civiles que de défense.
A ce titre, il est soumis en France à un contrôle strict : sa détention est réglementée par le code de la défense.
Au niveau de l’Union Européenne, des contrôles sont exercés par la Commission européenne dans le cadre du chapitre VII du Traité Euratom afin de s’assurer que les matières nucléaires, dont l’uranium, sont utilisées conformément aux usages déclarés par leurs détenteurs. L’Agence internationale de l’énergie atomique (AIEA), quant à elle, effectue des contrôles de non-prolifération au niveau mondial afin de donner des garanties à la communauté internationale sur l’utilisation pacifique de ces matières.
QUELLES SONT LES PRINCIPALES UTILISATIONS DE L'URANIUM ?
Électronucléaire
L’uranium est utilisé comme combustible dans la plupart des
réacteurs nucléaires industriels. Sous le flux de neutrons, il subit des fissions formant des noyaux de masse inférieure à celle de l’uranium et générant de nouveaux neutrons. Ces nouveaux neutrons peuvent à leur tour entraîner des fissions sur des atomes voisins, d’où la notion de «
réaction en chaîne ».
Lors de ces réactions nucléaires de fission, la masse totale des atomes générés est inférieure à celle de l’atome initial. La différence est dissipée sous forme de chaleur qui est ensuite utilisée pour faire tourner des turbines générant de l’électricité.
Autres applications
Colorants
L’uranium naturel sous forme d’oxyde a été utilisé depuis l’Antiquité pour donner à des verres, des céramiques et des faïences de profonds reflets verts ou jaunes.
Armement conventionnel
Du fait de sa grande densité et dureté, l’uranium appauvri est aussi utilisé sous forme métallique dans des têtes d’obus conventionnels destinés à perforer le blindage de chars ou d’abris en béton.
Radioéléments pour le médical
L’uranium hautement enrichi peut être irradié dans des réacteurs de recherche pour la production de radioéléments (technetium-99) utilisés comme traceurs en
imagerie médicale.
Quels sont les effets de l'uranium dans le corps humain ?
L’uranium naturel est plus toxique du fait de ses propriétés de métal lourd qu’à cause de sa
radioactivité.
Le comportement biologique de l’uranium dans l’organisme dépend :
- De la forme chimique sous laquelle il est incorporé (un oxyde est beaucoup moins soluble qu’un nitrate) ;
- Sa voie d’entrée dans l’organisme (inhalation ou ingestion).
En cas d’ingestion d’un composé soluble d’uranium, à peine quelques pourcents sont absorbés dans le sang ; le reste est éliminé dans les selles. La fraction absorbée dans le sang se dépose essentiellement dans le squelette et dans les reins. Cependant, c’est essentiellement dans les reins que se manifeste la toxicité – les effets néfastes – de l’uranium sur l’organisme.
Après inhalation, la majorité des particules inhalées insolubles se déposent au niveau des poumons. Toutefois, une faible fraction est solubilisée dans le sang.
Quelle que soit la voie d’entrée, après passage dans le sang, l’uranium est rapidement et majoritairement excrété dans l’urine. Le reste étant transféré vers les tissus : vers les reins où il est retenu de façon temporaire (quelques jours) et vers le squelette (où l’uranium peut rester plusieurs années). Les os constituent le site de rétention à long terme puisqu’on y retrouve environ 70 % de l’uranium contenu dans le corps chez des personnes exposées de manière chronique (c’est-à-dire en continu).
Effet cancérogène de l’uranium
Le Centre international de recherche sur le cancer (CIRC/OMS) classe par défaut tous les radionucléides émetteurs de rayonnement alpha, dont l’uranium, dans le groupe des éléments dont l’effet cancérogène est avéré (groupe 1 du CIRC). Cependant, s’agissant spécifiquement de l’uranium, le CIRC souligne que les études connues n’apportent pas de preuves suffisantes de son effet cancérogène chez l’Homme.Par ailleurs, l’ATSDR (US-Agency for Toxic Substances and diseases registry), dans la mise à jour de son profil toxicologique de l’uranium (2013), rappelle que ni l’IARC (Agence internationale de recherche sur le cancer), ni l’EPA (Environmental Protection Agency) ont classé l’uranium naturel ou appauvri parmi les agents cancérogènes.
D'OÙ VIENT L'URANIUM ?
Fabriqué dans les étoiles
Il n’existe aucun noyau stable dont le numéro atomique serait supérieur à celui du bismuth (numéro atomique : 83). Pourtant, on trouve sur Terre des éléments plus lourds encore : le
thorium et l’uranium. Ils sont radioactifs et ils ont été formés, au sein des
étoiles, il y a plusieurs milliards d’années. C’est parce que leur période de décroissance radioactive est très grande (pour les isotopes de l’uranium naturel : des millions voire des milliards d’années selon les isotopes) qu’une partie de ces atomes est toujours présente jusqu’à notre ère.
Du fer jusqu’au bismuth, les atomes sont formés par des captures successives de neutrons. Ensuite, une décroissance radioactive de type « bêta-moins » (dans laquelle un neutron se transforme en proton) génère un élément de numéro atomique immédiatement supérieur.
Dans une supernova, c’est-à-dire une étoile super massive qui s’effondre sur elle-même en quelques millisecondes, la densité de matière extrême permet à un noyau de capturer plusieurs neutrons en une seule fois. Le noyau subit ensuite plusieurs transformations radioactives successives qui génèrent des éléments beaucoup plus lourds, dont l’uranium. Puis, dans un rebond explosif, la supernova explose et expulse ces noyaux dans le milieu interstellaire. Ils peuvent ensuite se rassembler autour d’une nouvelle étoile et s’agréger pour se retrouver dans les planètes comme notre Terre.
En revanche, dans une étoile comme notre
Soleil, les densités de neutrons sont si faibles au point qu’il s’y produit moins d’une capture de neutron par décennie.
Sources d'uranium anthropique
Les engrais phosphatés utilisés en agriculture apportent de l’uranium dans les sols : à raison d'environ 100 kg d'engrais par hectare et par an, cet apport annuel peut être estimé à près de 1mg/m2.
L’extraction minière de l’uranium peut aussi représenter une voie d’apport dans l’environnement. Les nombreuses études internationales, réalisées sur le sujet, ont montré que la contamination environnementale reste toujours limitée et que les teneurs en uranium correspondantes sont celles de nombreux sites naturels.
L'URANIUM DANS L'ENVIRONNEMENT
L’uranium, est un élément naturel omniprésent dans notre environnement. Pour comprendre son comportement dans l’environnement, il est important de connaître sa chimie qui est complexe en raison notamment de ses différents états d’oxydation. Les deux états d’oxydation les plus importants sont l’uranium (IV) et l’uranium (VI). De manière générale, les composés d’uranium (IV) sont très insolubles, alors que ceux d’uranium (VI) présentent des solubilités plus variées.
Dans les eaux
Ainsi dans les eaux naturelles, l’uranium est stable sous deux états d’oxydation : l’état d’oxydation VI prédomine dans les milieux oxydés comme les eaux de surface, et l’état d’oxydation IV prédomine dans les milieux réduits, c’est-à-dire les eaux profondes dont l’oxygène est absent.
Selon la composition du milieu (pH, anions caractéristiques du milieu, conditions d’oxydo-réduction …), l’uranium peut être présent sous différentes formes chimiques dont la proportion va varier.
Dans les sols
Dans les sols comme dans les eaux, selon les conditions du milieu (oxydé ou réduit), l’uranium est présent sous différentes valences. L’uranium se trouve à l’état naturel à différentes concentrations dans les sols et les eaux ; il a également été mesuré dans des météorites à des teneurs variant de 90 à 360 microgramme par kilogramme de matière.
Milieu
|
Concentration en mg/kg |
Mer
| 0,003 |
Roche basaltique
| 0,5 |
Sol calcaire
| 1 |
Écorce terrestre
| 2 |
Roche granitique
| 5 |
Phosphate
| 100 |
Gisement uranifère
| 10 000 |
Le tableau ci-dessus donne l'ordre de grandeur des concentrations d'uranium rencontrées naturellement dans différents milieux. Ce tableau illustre la grande disparité des concentrations d'uranium rencontrées dans la nature. Il démontre aussi et surtout l'omniprésence de cet élément sur Terre.
Migration de l'uranium dans l'environnement
Le comportement de l'uranium dans l'environnement dépend des conditions du milieu. Dans chaque système naturel, il existe des conditions spécifiques (pH, potentiel redox, force ionique, teneur en matière organique) pour lesquelles la mobilité de l'uranium est minimale. En milieu oxydant, l’uranium se trouve sous la valence VI, qui est la forme la plus stable et la plus mobile. En conditions anaérobies, il peut être réduit à la valence IV.
Norme OMS pour l'eau potable
La valeur guide provisoire pour l’eau de boisson retenue par l’OMS est de 30 microgramme/L (OMS, 2012). Elle est fondée sur les résultats d’études épidémiologiques récentes dans des populations exposées à des concentrations élevées d’uranium.
L'uranium a une mobilité moyenne dans les sols. En condition aérobie, il se complexe facilement avec la matière organique, les carbonates, les phosphates et les sulfates. La présence de substances humiques conduit à une fixation plus efficace de l'uranium dans les sols. Ceci peut conduire à l'existence de zones d'accumulation dans les horizons riches en matières organiques. La présence d'ions carbonates dans les sols conduit à la formation de composés chargés négativement, plus mobiles.
Ces mécanismes de complexation conditionnent le comportement de l'uranium dans les sols, ce qui explique que, dans les sols non remaniés, la répartition de l'uranium n'est pas homogène selon la profondeur du sol.
Réacteur nucléaire naturel
Certains sites géologiques favorisent la concentration de l’uranium dans les milieux naturels. Ainsi, la teneur en uranium peut atteindre plusieurs centaines de milligrammes par kilogramme de sol ou de roche dans des sites comme Cigar Lake au Canada, Pocos de Caldas au Brésil, El Berocal en Espagne. Des conditions hydrogéologiques favorables, associées à une concentration d'uranium adaptée, ont même conduit, il y a près de 2 milliards d'années, à l’existence de réacteurs nucléaires naturels tels que celui d’Oklo au Gabon.
Alimentation
La présence naturelle de l'uranium dans notre environnement conduit à l'ingestion quotidienne de cet élément par l’alimentation.
La présence d'uranium disponible dans les sols conduit à la présence d'uranium dans les végétaux qui s'y développent. Les concentrations dans les végétaux dépendent du type de sol et de la partie du végétal considérée ; en règle générale, l'uranium se retrouve en proportion plus importante dans les racines et les plantes que dans les graines. Chez les animaux, la présence d'uranium est liée à leur consommation de végétaux et de leur eau d'abreuvement, voire de l'ingestion directe de sol.
A partir de mesures d'uranium en dehors de l’influence d’installations nucléaires, l’UNSCEAR évalue l’activité dans l’air en 238U aux environs de 1 μBq.m-3.
L'absorption de l'uranium par inhalation est très faible et l'absorption par ingestion est de l'ordre de 1 à 4 µg par jour.
Compte tenu de l'existence de sols uranifères traversés par les eaux souterraines alimentant sources et puits, certaines eaux de boissons contiennent des concentrations d'uranium supérieures à 50 µg/L, voire supérieures à 7 800 µg/L dans certaines régions telles que la Finlande. En moyenne néanmoins, la quantité d’uranium apportée quotidiennement via l’alimentation est de l’ordre de quelques microgrammes, principalement par les coquillages et dans une moindre mesure, les légumes frais, les céréales et les poissons.