Nos objectifs de recherche
Les maladies neurodégénératives sont largement associées à des altérations métaboliques et structurelles des cellules, qui peuvent précéder la mort des neurones. L’équipe de méthodologie en résonance magnétique développe des méthodes originales pour évaluer le métabolisme et la structure cellulaire de manière non-invasive, en particulier dans les modèles animaux développés au sein de l'UMR9199, sur les systèmes IRM 7 Tesla et 11,7 Tesla de MIRCen. L’objectif ultime est double : proposer de nouveaux biomarqueurs des maladies neurodégénératives, et mieux comprendre les processus physiopathologiques à l’œuvre dans ces maladies.
Figure 1 :
Quantification des métabolites cérébraux dans un volume du cerveau de primate in vivo à 7 T.
Au-delà de la simple mesure de concentration des métabolites cérébraux accessibles en spectroscopie du proton (Figure 1), notre groupe développe des approches d’imagerie par effet CEST (« Chemical Exchange Saturation Transfer », Figure 2), afin de cartographier avec une bonne résolution spatiale la distribution de certains métabolites endogènes tels que le glutamate (impliqué à la fois dans le métabolisme énergétique et la neurotransmission) ou le glucose (principale source énergétique des cellules cérébrales).
mesurée sur le scanner 11,7 T. [Adapté de Pépin et al., Neuroimage 2016]
Le groupe est fortement impliqué dans le développement de méthodes de spectroscopie des noyaux X pour mesurer certains grands flux du métabolisme énergétique : spectroscopie du carbone 13 (13C) pour mesurer la vitesse du cycle de Krebs (VTCA) ; spectroscopie et imagerie de l’oxygène 17 (17O) (Figure 3) pour mesurer la vitesse de la respiration cellulaire (CMRO2) elle-même couplée au cycle de Krebs ; et spectroscopie du phosphore 31 (31P) pour mesurer la vitesse de synthèse d’ATP par phosphorylation oxydative (VATP).
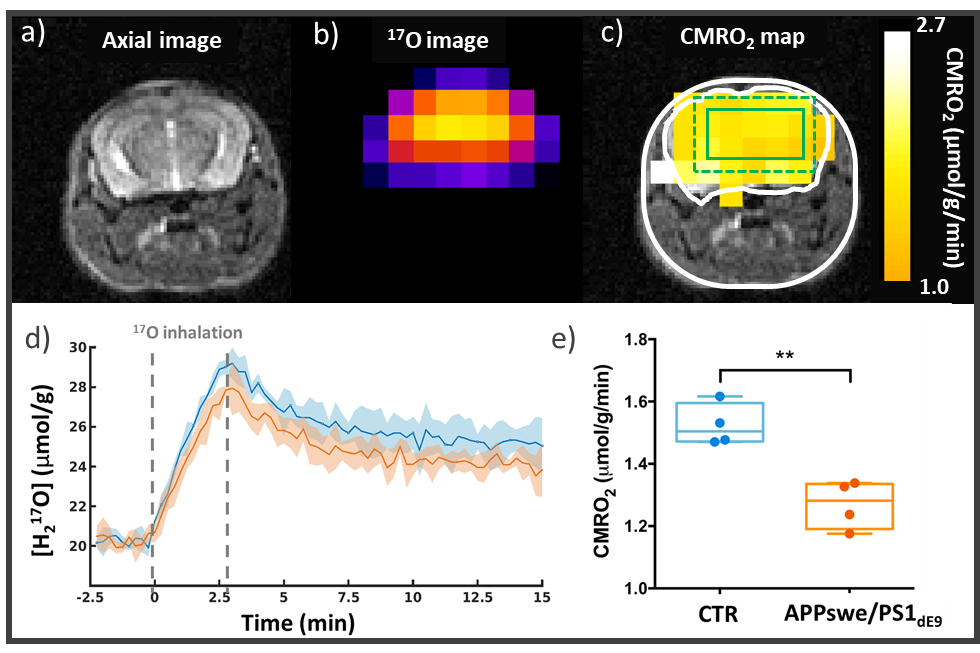
Figure 3 : Altération de CMRO2 dans le cerveau d’un modèle souris d’amyloidose (APPswe/PS1dE9). a) Image anatomique 1H et b) imagerie zéro temps d’écho 17O sont acquises sur le scanner 11,7 T. L’acquisition d’une série d’images rapides 17O avant, pendant et après l’inhalation de gaz O2 enrichi en 17O (70%) permet de détecter la production H217O mitochondriale et de calculer des cartes de CMRO2 (c). d) Evolution du signal H217O chez des souris APPswe/PS1dE9 (n=4, orange) et WT (n=4, blue) (± SD). e) La quantification de CMRO2 montre une vitesse de consommation d’oxygène plus lente chez les souris APPswe/PS1dE9.
De manière complémentaire, un projet en cours porte sur l’utilisation de l’imagerie CEST du glucose pour cartographier la consommation de glucose cérébral (CMRglc). Une des particularités de notre équipe est de combiner ces approches afin d’obtenir la vision la plus intégrée possible du métabolisme énergétique (Figure 4).
Figure 4: Flux métaboliques de la synthèse énergétique mitochondriale, mesurée par notre groupe dans le cerveau de primate. Les flux sont indiqués en µmol/g/min.
Adapté de [Chaumeil et al., PNAS 2009].
Nous étudions également la possibilité d’évaluer l’organisation du milieu intracellulaire, de manière indirecte, en mesurant par des techniques de spectroscopie pondérée en diffusion la façon dont cette organisation contraint le déplacement des métabolites intracellulaires. Notre groupe a notamment exploré la diffusion des métabolites cérébraux sur des échelles de temps encore jamais atteintes, ce qui nous a permis de mieux caractériser la compartimentation des métabolites et les paramètres déterminant leur mouvement. Nous développons également de nouvelles approches de modélisation de la diffusion (en collaboration avec le groupe du Dr Palombo à University College London), afin d’extraire des informations quantitatives sur la structure cellulaire à partir des données expérimentales de diffusion. Nous avons notamment montré qu’il était possible de différencier la structure des neurones et des astrocytes, en étudiant la diffusion de métabolites majoritairement présents dans les neurones ou dans les astrocytes (Figure 5). Nous nous intéressons désormais à la possibilité d’utiliser la spectroscopie pondérée en diffusion pour évaluer la distribution du lactate cérébral dans les différents compartiments (neurones, astrocytes, milieu extracellulaire…), ce qui est en rapport avec le mécanisme de la navette lactate. Ces thématiques ont fait l’objet de deux financements par l’ERC (projets « INCELL » et « LactaDiff »).
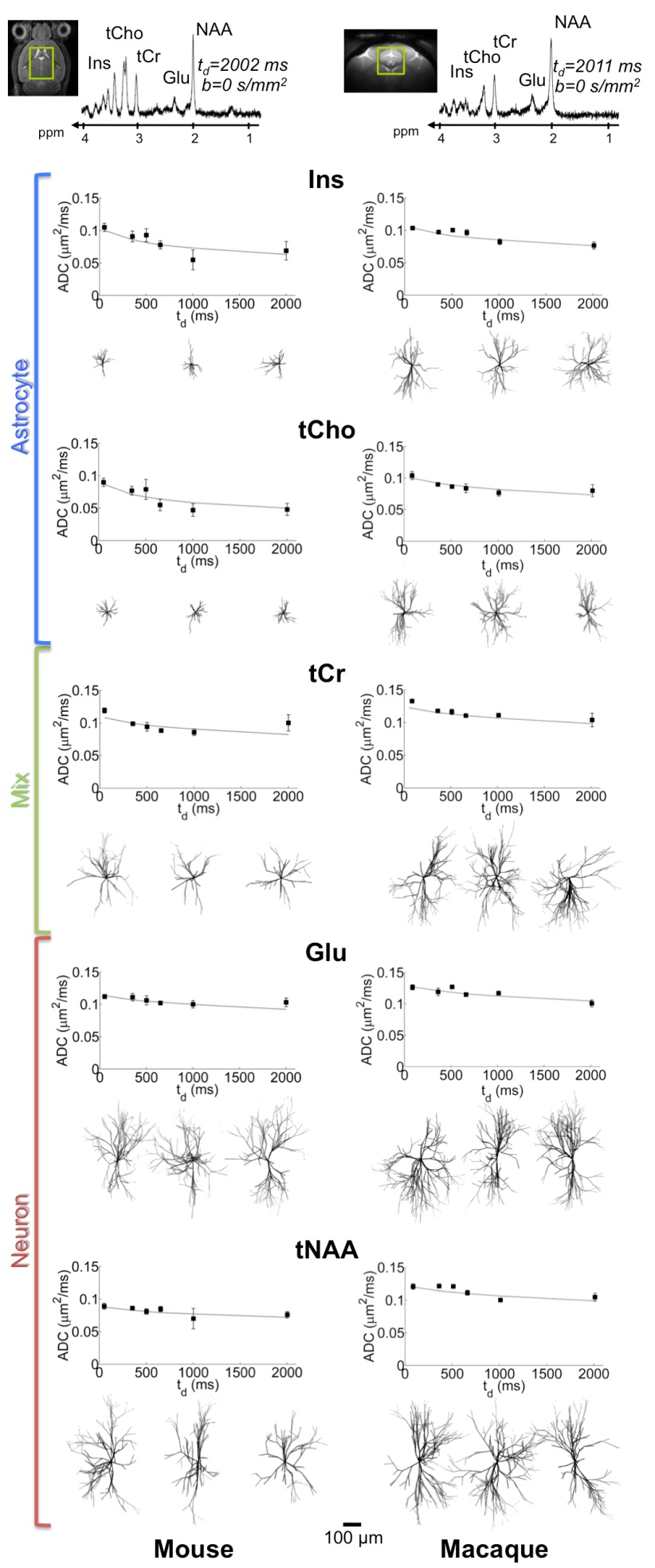
Figure 5 : Etudier la dépendance temporelle du coefficient de diffusion des métabolites à temps de diffusion ultra-long permet d’estimer la structure à grande échelle des cellules du cerveau. En s’intéressant à des métabolites essentiellement astrocytaires (myo-inositol par exemple) ou essentiellement neuronaux (NAA par exemple), il est même possible de différencier la structure des astrocytes et des neurones [Palombo et al., PNAS 2016]).
Membres du groupe
- Julien Valette (chercheur CEA) : chef d’équipe et responsable de la thématique spectroscopie de diffusion
- Céline Baligand (chercheur CEA) : responsable
de la thématique noyaux X
- Julien Flament (chercheur CEA) : responsable de la thématique CEST
- Eloïse Mougel (post-doctorante) : séquence
de spectroscopie de diffusion
- Rodrigo Lerchundi (post-doctorant) :
imagerie FRET du lactate
- Amélie Tourais (doctorante) : imagerie du 17O
- Sophie Malaquin (doctorante) : mesure de la
diffusion des métabolites cérébraux
- Yohann Mathieu-Daudé (doctorant) : imagerie
CEST du glucose
- Jean-Baptiste Pérot (doctorant) : imagerie
CEST du glutamate
- Mélissa Vincent (doctorante) : mesure de la
diffusion des métabolites cérébraux
Anciens membres du groupe
- Jérémy Pépin (doctorant) : imagerie CEST du
glutamate
- Khieu Van Nguyen (post-doctorant) : modélisation
de la diffusion
- Edwin Hernandez-Garzon
(post-doctorant): microscopie confocale, morphométrie cellulaire
- Clémence Ligneul (doctorante) :
spectroscopie de diffusion
- Marco Palombo (post-doctorant) : modélisation de
la diffusion
- Brice Tiret
(doctorant) : spectroscopie des noyaux X
- Chloé Najac (doctorante) : spectroscopie des
noyaux X, spectroscopie de diffusion
- Charlotte Marchadour (doctorante) : spectroscopie
des noyaux X, spectroscopie de diffusion
Collaborations
- Danish Research Centre for Magnetic Resonance (H. Lundell)
- Université de Bordeaux / RMSB (A.-K.
Bouzier-Sore)
- University College London (M. Palombo)
- Université du Minnesota (P.-G. Henry, M.
Marjanska)
- Université de Leiden (I. Ronen)
- EPFL (C. Cudalbu, R. Gruetter)
- Institut du cerveau et de la moelle (F. Branzoli,
S. Lehéricy)
Financement principaux
ERC : projet LactaDiff (2019-2024), projet INCELL (2013-2018)
ANR : projet nrjCEST (2018-2021), projet HDeNERGY (2015-2019)
Publications récentes
Zero Echo Time 17O-MRI Reveals Decreased Cerebral Metabolic Rate of Oxygen Consumption in a Murine Model of Amyloidosis. Baligand C, Barret O, Tourais A, Pérot JB, Thenadey D, Petit F, Liot G, Gaillard MC, Flament J, Dhenain M, Valette J.
Metabolites. 2021;11(5):263. doi: 10.3390/metabo11050263.
Revisiting double diffusion encoding MRS in the mouse brain at 11.7T: Which microstructural features are we sensitive to?
Vincent M, Palombo M, Valette J.
Neuroimage 2020;207:116399. doi: 10.1016/j.neuroimage.2019.116399.
Brain Metabolite Diffusion from Ultra-Short to Ultra-Long Time Scales: What Do We Learn, Where Should We Go?
Valette J, Ligneul C, Marchadour C, Najac C, Palombo M.
Front Neurosci. 2018;12:2. doi: 10.3389/fnins.2018.00002
Insights into brain microstructure from in vivo DW-MRS.
Palombo M, Shemesh N, Ronen I, Valette J.
Neuroimage 2018;182:97-116. doi: 10.1016/j.neuroimage.2017.11.028.
Probing metabolite diffusion at ultra-short time scales in the mouse brain using optimized oscillating gradients and “short” echo time diffusion-weighted MR spectroscopy.
Ligneul C, Valette J.
NMR in Biomedicine 2017;30(1). doi: 10.1002/nbm.3671.
Conférence-débat de l'Académie des sciences
Conférence sur la RMN - Prolongements récents de l'oeuvre d'Anatole Abragam / NMR and its applications beyond Anatole Abragam's achievements :
lien site internet