Axes et objectifs de recherche
TOP
La maladie d'Alzheimer : nouveaux mécanismes pour les futures thérapies
Des outils d'imagerie innovants pour une meilleure compréhension des maladies neurodégénératives
Contributions à la science
Membres du laboratoire associés à ces projets
Collaborations externes
Subventions récentes
Sélection de publications récentes
Maladie d'Alzheimer : nouveaux mécanismes pour les futures thérapies
AD
La maladie d'Alzheimer est liée à la présence de trois lésions complémentaires : Les lésions amyloïdes-β (Aβ) et tau et la neuroinflammation. Notre groupe évalue les mécanismes associés à la survenue de ces lésions et à l'impact de ces lésions sur les pertes synaptiques et les troubles fonctionnels associés à la maladie d'Alzheimer.
1.
La pathologie de la maladie d'Alzheimer est transmissible y compris chez les primates
AD1
Notre groupe a démontré que les lésions Aβ et tau sont transmissibles et peuvent se propager dans le cerveau de souris et chez les primates (Gary, 2019). Cette transmission permet d'explorer les mécanismes physiopathologiques conduisant à la maladie d'Alzheimer.
En plus des études chez la souris, nous étudions la pathologie d'Alzheimer chez les primates (
Microcebus murinus). Le microcèbe est un modèle des pathologies neurodégénératives liées au vieillissement. Cet animal présente, en vieillissant, des altérations cognitives, des altérations du métabolisme cérébral, une atrophie cérébrale et des dépôts amyloïdes.
Cliquer sur l'image pour l'agrandir
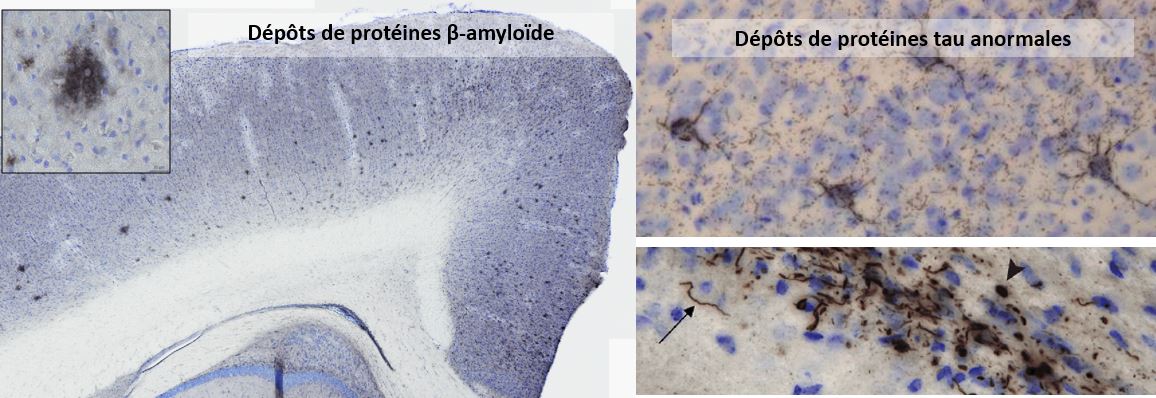
Lésions amyloïdes et tau induites dans le cerveau de modèles expérimentaux suite à
l'inoculation de facteurs de nucléation amyloïde et tau
Exemples de projets en cours
- Évaluation de l'impact de formes purifiées d'Aβ avec des mutations très spécifiques (PI. M Dhenain, AS Herard, Vaincre Alzheimer, France Alzheimer, collaboration avec Alain Buisson de l'Institut des Neurosciences de Grenoble).
- Évaluation de l'impact de la transmission des lésions Aβ et tau sur la neuroinflammation, la perte synaptique et la fonction cérébrale (PI. M Dhenain, InductAlz, PrimAlz, collaboration avec Stéphane Haik (ICM, Paris), Luc Buée (Université de Lille)).
2.
Diversité structurale des amyloïdes dans la maladie d'Alzheimer
AD2
L'assemblage des protéines Aβ et Tau en fibrilles joue un rôle essentiel dans la médiation de l'auto-propagation et de la transmission inter-cellulaire des fibrilles amyloïdes pathologiques dans la maladie d'Alzheimer. Notre objectif est de caractériser l'hétérogénéité des fibrilles amyloïdes Aβ et Tau présentes chez l'homme, la souris et le primate et d'évaluer les relations entre cette diversité et leurs impacts pathologiques.
Exemples de projets en cours
- Nouvelles méthodes de purification d'assemblages de très haut poids moléculaire à partir de tissus cérébraux et d'extraits cytosoliques (PI. L. Bousset, Cryomet, collaboration avec AA Arteni, S. Bressanelli, I2BC, Gif sur Yvette, France).
3. Mécanismes de propagation dans la maladie d'Alzheimer
AD3
L'auto-réplication et la propagation transcellulaire des protéines tau sont responsables de l'accumulation progressive de dépôts de protéines tau mal repliées dans le cerveau des patients atteints de la maladie d'Alzheimer. La propagation de tau est en corrélation avec la gravité du déclin cognitif. Notre groupe caractérise les facteurs médiateurs et régulateurs de la propagation de tau car ils représentent des cibles pertinentes pour les futures thérapies.
Cliquer sur l'image pour l'agrandir
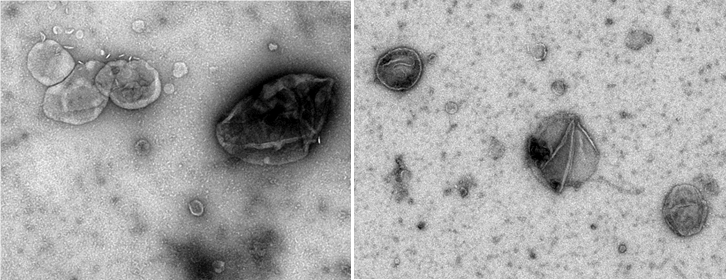 Vésicules extracellulaires cérébrales visualisées par microscopie électronique à coloration négative (crédit M. Kabani)
Vésicules extracellulaires cérébrales visualisées par microscopie électronique à coloration négative (crédit M. Kabani)
Exemple de projets en cours
- Profilage moléculaire des espèces de tau extracellulaires (exTau) - libres ou associées à des lipoprotéines, des composants de la matrice extracellulaire ou des vésicules extracellulaires - dérivées du cerveau de patients Alzheimer et évaluation de leur rôle dans la propagation et l'agrégation de tau (PI. M. Kabani, collaboration avec I.Vorberg, DZNE, Allemagne).
- Évaluation du rôle des héparane-sulfates neuronaux dans la propagation de la pathologie Tau médiée par les vésicules extracellulaires (PI. M. Kabani, collaboration avec D. Papy Garcia, gly-CRRET, U-PEC, France).
- Évaluation de l'impact de la réplication et de la diversification structurale des prions sur leur dissémination cérébrale (PI. M. Dhenain, ANR 2021-2024 (PrionDiff). Collaboration avec H. Rezaei, V. Beringue, INRAE, France).
Des outils d'imagerie innovants pour une meilleure compréhension des maladies neurodégénératives
IM
Les maladies neurodégénératives sont liées à de nombreux "événements à petite échelle" (accumulation de protéines pathologiques, neuroinflammation, altérations cellulaires) qui conduisent à des événements à grande échelle (perte de tissu, altérations des réseaux, troubles cognitifs). Notre équipe développe des outils pour intégrer des événements se produisant à différentes échelles. Ces nouveaux outils nécessitent des compétences avancées en imagerie combinées à l'intelligence artificielle, à la gestion des mégadonnées et au calcul haute performance.
Cliquer sur l'image pour l'agrandir
Vue d'ensemble de la gamme de méthodes d'imagerie mises en œuvre par notre groupe.
Il s'agit de méthodes de pointe pour manipuler une grande quantité de données qui nécessitent
parfois la mise en place de calcul haute performance (HPC).
1. Méthodes d'imagerie microscopique 3D basées sur le calcul haute performance (HPC) et l'intelligence artificielle
IM1
Notre groupe met en œuvre des chaînes de traitement d'images pour effectuer une histologie 3D chez les primates et les rongeurs. Les échantillons de cerveau reconstruits en 3D peuvent être analysés à l'aide d'une analyse manuelle semi-automatique, d'une analyse basée sur un atlas numérique (Lebenberg, 2011) ou d'une approche SPM sans a priori (Vandenberghe, 2018). La méthode peut être utilisée pour détecter des lésions telles que les plaques amyloïdes liées à la maladie d'Alzheimer (Vandenberghe, 2018). De nouvelles méthodes sont développées pour intégrer l'intelligence artificielle, la gestion de données massives et le calcul haute performance dans nos analyses. Nos méthodes sont principalement développées à l'aide de la plateforme logicielle interne BrainVISA (http://brainvisa.info) et de ressources de calcul haute performance (HPC) (supercalculateur du TGCC - CEA, Bruyères-le-Châtel).
Cliquer sur l'image pour l'agrandir
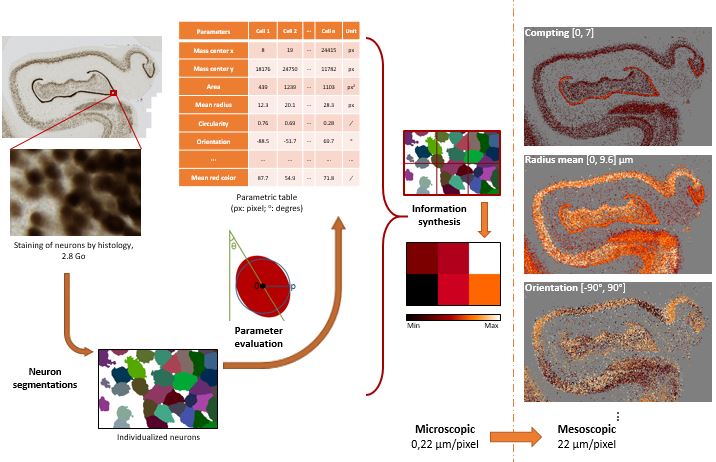
Méthodes utilisées pour évaluer la densité neuronale et d'autres paramètres neuronaux basés sur le calcul HPC.
Les coupes cérébrales colorées pour les cellules (anticorps NeuN) sont segmentées et divers paramètres reflétant les caractéristiques neuronales (par exemple, leur densité, leur taille, leur orientation, etc.) sont calculés. Sur la base de cette analyse, nous pouvons produire des cartes paramétriques reflétant les états neuronaux au niveau de l'ensemble du cerveau.
Ces cartes peuvent ensuite être comparées à d'autres cartes (lésion, fonction cérébrale, etc…).
Exemples de projets en cours
- Quantification neuronale au niveau du cerveau entier par algorithme d'apprentissage automatique : De la forêt aléatoire aux réseaux de neurones (PI. T. Delzescaux, Dim Elicit 2020-2023).
- Analyse automatique de coupes histologiques 2D à partir d'un atlas numérique 3D (PI T. Delzescaux, Neoxia 2019-2022, thèse CIFRE).
- Modèles computationnels pour le décodage de la cytoarchitecture du cerveau humain (PI. T. Delzescaux, Programme transversal de santé numérique).
- De l'histologie 3D aux jumeaux numériques de cerveaux – Nouveaux paradigmes pour produire des modèles mathématiques réalistes de la cytoarchitecture (PI. T. Delzescaux, collaboration avec C. Poupon (NeuroSpin), DAM, Labo anatomie de Tours).
- Maladies des petits vaisseaux : modèle computationnel ultrastructure & microvasculature pour affiner le traitement individuel (PI. T. Delzescaux, ANR2021-2024 SUMMIT, collaboration avec C. Poupon (NeuroSpin), hôpitaux de Lariboisière, Sainte-Anne, Bretonneau et de Tours)
- Nouveaux outils pour l'imagerie par feuille de lumière (PI. T. Delzescaux, France Relance, Collaboration avec JP Deslys (CEA-SEPIA) & Imagine Optic (Orsay)).
2. Imagerie in vivo des réseaux fonctionnels
IM2
Les cellules individuelles du cerveau fonctionnent de manière harmonisée, ce qui conduit à une activité cérébrale harmonieuse à travers les réseaux fonctionnels. Ces réseaux peuvent être évalués par l'IRM fonctionnelle à l'état de repos et des outils de traitement d'image sophistiqués. Notre groupe étudie l'activité cérébrale avec l'imagerie fonctionnelle à l'état de repos. Il a mis en place des méthodes pour détecter les réseaux neuronaux chez les rongeurs (Célestine, 2020 ; https://sammba-mri.github.io/; Grandjean, 2020) et les primates (Garin, 2021).
Cliquer sur l'image pour l'agrandir
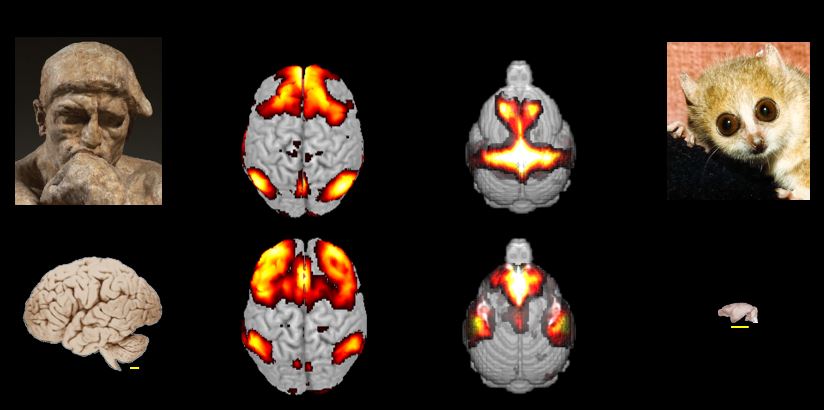
Exemple de détection de réseaux de neurones chez l'homme et chez le plus petit primate du monde
(microcèbe murin) par imagerie par résonance magnétique
Exemples de projets en cours
- Atlas numérique du cerveau des lémuriens de la souris (PI. JL Picq)
- Évaluation comparative de l'anatomie cérébrale et des réseaux neuronaux chez les primates (PI. JL Picq, C. Garin)
- Impact des lésions d'Alzheimer sur la connectivité fonctionnelle (PI. M. Dhenain, France Alzheimer, 2021-2023).
- Impact du traumatisme crânien sur la connectivité fonctionnelle (PI. M. Dhenain, Service de Santé des Armées).
- StandardRat : Protocole multicentrique pour améliorer la mesure de la connectivité fonctionnelle dans le cerveau du rat (PI. M. Dhenain, Collaboration avec J. Grandjean, Radboud University Medical Center, Pays-Bas)
Contributions à la Science
Coll
Membres du laboratoire associés aux projets MEM
- Luc Bousset (chercheur CNRS) -
https://orcid.org/0000-0002-0433-4337
-
Thierry Delzescaux (directeur de recherche CEA, HDR) - https://orcid.org/0000-0002-6527-7946
- Marc Dhenain (directeur de recherche, CNRS, DVM, HDR) -
https://orcid.org/0000-0001-8804-4101
- Mehdi Kabani (Chercheur CNRS, HDR) -https://orcid.org/0000-0001-7440-6394
-
Jean-Luc Picq (chercheur Univ. Paris XIII, Professeur) -
https://orcid.org/0000-0003-1872-3437
-
Anne- Sophie Hérard (ingénieur de recherche CEA) - https://orcid.org/0000-0001-8260-9618
- Camille Mabillon (technicienne CEA, histologie)
-
Fanny Petit (technicienne CEA, histologie) -
https://orcid.org/0000- 0003-2757-3434
- Nicolas Souedet (ingénieur de recherche CEA, calcul haute performance)
- Marina Célestine (doctorante, Université Paris Saclay)
- Lilian Mehl (France Relance)
- François Plumerault (France Relance)
- Huaqian Wu (doctorant, DIM)
Collaborations externes COLLE
- Ana -Andreea Arteni, Stéphane Bressanelli, I2BC, Gif sur Yvette, France
- Luc Buée, David Blum - Université de Lille, France
- Alain Buisson - Institut des Neurosciences de Grenoble, France
- Gaël Chételat - Université de Caen, France
- Christos Constantinidis, Université Vanderbilt , USA
- Jean-Philippe Deslys, SEPIA, Fontenay aux Roses, France
- Joanes Grandjean - Radboud University Medical Center, The Net herlands
- Stéphane Haïk, Benoît Delatour - Institut du Cerveau, France
- Han Wei Hou - Nanyang Technological University, Singapour
- Dulce Papy-Garcia - Université Paris Créteil, France
- Fabien Pifferi, Fabienne Aujard - CNRS, Brunoy, France
- Cyril Poupon - Neurospin, Gif sur Yvette, France
- Human Rezaei, Vincent Beringue – INRAE, Jouy en Josas, France
- Stephen Sawiak - Cambridge University, UK
- Elisabeth Traiffort – INSERM, Le Kremlin-Bicêtre, France
- Ina Vorberg – DZNE, Bonn, Allemagne
Partenaires Industriels
Subventions récentes SUB
- ANR 2020-2024. PrionDiff : Impact de la réplication et de la diversification structurale des prions sur leur dissémination cérébrale
- ANR 2020-2023. SUMMIT : Maladies des petits vaisseaux : modèle computationnel de l'ultrastructure et de microvascularisation pour affiner le traitement individuel
- École doctorale LSH – Université Paris Saclay 2022. CryoMET. Exploitation des méthodes de cytométrie en flux pour la purification ex-vivo de complexes extra-larges pour l'analyse de structure cryo-EM
- FRISBI 2021&2022 : Caractérisation des graines de tau dérivées du cerveau et associées aux vésicules extracellulaires à l'origine de la maladie d'Alzheimer
- Ministère de l'Enseignement Supérieur, de la Recherche et de l'Innovation-2022-2023. Impact de souches amyloïdes spécifiques sur la progression de la maladie d'Alzheimer : vers la compréhension du rôle central de l'interaction amyloïde/Tau sur la propagation des mécanismes de la maladie d'Alzheimer.
- PTC-SN 2021-2022. Modèles computationnels pour le décodage in-vivo de la cytoarchitecture du cortex cérébral humain
- Service santé des Armées . Activation des processus inflammatoires périphériques et prise en charge suite à un traumatisme crânien : implication des systèmes catécholaminergiques et corticotrope
- Région IdF 2019-2022. CARTOBRAIN - Cartographie haute résolution des réseaux de neurones par microscopie optique en recherche préclinique
- DIM Elicit 2020-2023. ENCOMPASS - Evaluation des méthodes de comptage neuronal dans les études précliniques
- DARI-A10-TGCC. Calcul intensif pour l'analyse par machine learning de données massives 3D de microscopie de cerveaux
- France Relance: développements de traitement d'image pour améliorer l'analyse d'images en feuille de lumière
Alumni ALU
Professeur invité
James Koch, Professeur,Université du Wisconsin, Oshkosh, USA
Post-docs
Salma Bougacha
Nachiket
Matthias Vandesquille
Chrystelle Po
Matthieu Santin
Alexandra Petiet
Oliviero Gobbo
Géraldine Poisnel
Elmahdi Sadouni |
Doctorants
Sébastien Piluso
Suzanne Lam
Clément Bouvier
Clément Garin
Zhenzhen You
Yael Balbastre
Michel Vandenberghe
Clémence Dudeffant
Mathieu Bonnet
Charlotte Gary
Anne Bertrand
Olene Dorieux
Nelly Joseph-Mathurin
Audrey Kraska
Jessica Lebenberg
Albertine Dubois
Julien Dauguet |
Autres étudiants
Alice Fermigier
Emmalaurie Baptiste
Lisa Ciaptacz
Zoé Hanss
Mireilla Peterson
Kelly Herbert
Cecile Cardoso
Maggie Roy
Adrien Pasquier
Myriam Ly
Alexandra Danho
Sang Xuan
Remi Mariani
Guillaume Campeggi
Jean-Luc Lor
Olivier Teboul
Abdelmonem Feki
|
Sélection de publications récentes & thèses
PUB
2022
An evolutionary gap in primate default mode network organization.
Garin C. M., Hori Y., Everling S., Whitlow C. T., Calabro F. J., Luna B., Froesel M., Gacoin M., Ben Hamed S, Dhenain M., Constantinidis C.
Cell Reports. 39, 2, 110669, April 12, 2022: https://doi.org/10.1016/j.celrep.2022.110669.
Macaque neuron instance segmentation only with point annotations based on multiscale fully convolutional regression neural network.
You Z, Jiang M, Shi Z, Shi C, Du S, Liang J, Hérard AS, Jan C, Souedet N, Delzescaux T.
Neural Computing and Applications. 2021. 34, 2925–2938 (2022): https://doi.org/10.1007/s00521-021-06574-7.
An evolutionary gap in primate default mode network organization.
Garin C. M., Hori Y., Everling S., Whitlow C. T., Calabro F. J., Luna B., Froesel M., Gacoin M., Ben Hamed S, Dhenain M., Constantinidis C.
Cell Reports. 39, 2, 110669, April 12, 2022: https://doi.org/10.1016/j.celrep.2022.110669.
Whole brain mapping of glutamate distribution in adult and old primates at 11.7 T.
Garin C. M., Nadkarni N. A., Pépin J., Flament J., Dhenain M.
NeuroImage, 251, 1 May 2022, article. 118984: https://doi.org/10.1016/j.neuroimage.2022.118984.
Neurons with Cat's Eyes: A synthetic strain of α-synuclein fibrils seeding neuronal intranuclear inclusions.
De Giorgi F, Abdul-Shukkoor MB, Kashyrina M, Largitte LA, De Nuccio F, Kauffmann B, Lends A, Laferrière F, Bonhommeau S, Lofrumento DD, Bousset L, Bezard E, Buffeteau T, Loquet A, Ichas F.
Biomolecules. 2022 Mar 11: https://doi.org/10.3390/biom12030436.
Sébastien Piluso (2018-2022) : Automatic segmentation of individual sections of mouse brains by 3D digital atlas. PhD Thesis
2021
Evaluation of automated segmentation algorithms for neurons in macaque cerebral microscopic images.
You, Z., M. Jiang, Z. Shi, X. Ning, C. Shi, S. Du, A. S. Hérard, C. Jan, N. Souedet, Delzescaux T.
Microscopy Research and Technique. 2021: 27 Apr 2021: https://doi.org/2010.1002/jemt.23786.
Alzheimer’s brain inoculation in Aß-plaque bearing mice: synaptic loss is linked to tau seeding and low microglial activity.
Lam S., Boluda S., Hérard A.S., Petit F., Eddarkaoui S., Cambon K., The Brainbank Neuro-CEB Neuropathology Network, Picq J.L., Buée L., Duyckaerts C., Haïk S., Dhenain M.
BioRxiv. 2021. https://doi.org/10.1101/2021.04.06.438654
Resting state functional atlas and cerebral networks in mouse lemur primates at 11.7 Tesla.
Garin C. M., Nadkarni N. A., Landeau B., Chételat G., Picq J-L, Bougacha S., Dhenain M.
NeuroImage, 226, 117589, 2021. https://doi.org/10.1016/j.neuroimage.2020.117589
Suzanne Lam (2017-2021) : "Transmission of Alzheimer pathology in murine and primate models: from proteinopathies to neuronal and cognitive impairments". PhD Thesis
2020
Induction of amyloid-beta deposits from serially transmitted, histologically silent, A-beta seeds issued from human brains.
Herard A.S., Petit F., Gary C., Guillermier M., Boluda S., Garin C. M., French Neuropathology Network, Lam S., Dhenain M.
Acta Neuropathologica Communications. 8, Article number: 205, 2020. https://doi.org/10.1186/s40478-020-01081-7
Modèles primates et innovations thérapeutiques contre les maladies du système nerveux central.
Dhenain M.
La Lettre de l'Académie des Sciences. 2020. n°40, p34. 2020 - https://www.academie-sciences.fr/pdf/lettre/lettre40.pdf.
Effects of chronic masitinib treatment in APPPS1dE9 transgenic mice modeling Alzheimer's disease, 2020.
Li T., Martin E., Abada Y., Boucher C., Cès A., Youssef I., Fenaux G., Forand Y., Legrand A., Nadkarni N., Dhenain M., Hermine O., Dubreuil P., Delarasse C., Delatour B.
Journal of Alzheimer's Disease. 76.4. 1339-1345, 2020. https://doi.org/10.3233/JAD-200466
Sammba-MRI, a library for small animal neuroimaging data processing in Python.
Celestine M.*, Nadkarni N.A.*, Garin C., Bougacha S.*, Dhenain M.
Frontiers in NeuroInformatics. 28 May 2020 | https://doi.org/10.3389/fninf.2020.00024. (These three authors participated equally to the work)
An automated open-source workflow for standards-compliant integration of small animal magnetic resonance imaging data.
Ioanas H-I., Marks M., Garin C. M., Dhenain M., Yanik M. F., Rudin M..
Frontiers in Neuroinformatics. 2020. https://doi.org/10.3389/fninf.2020.00005
Animal functional magnetic resonance imaging: Trends and path toward standardization.
Mandino F., Cerri D. H., Garin C. M., Straathof M., van Tilborg G. A. F., Chakravarty M. M., Dhenain M., Dijkhuizen R. M., Gozzi A., Hess A., Keilholz S. D., Lerch J. P., Ian Shih Y-Y., Grandjean J.
Frontiers in Neuroinformatics. 2020. Vol. 13. Art 78. https://doi.org/10.3389/fninf.2019.00078.
Common functional networks in the mouse brain revealed by multi-centre resting-state fMRI analysis.
Grandjean J., Canella C., Anckaerts C., Ayrancı G, Bougacha S., Bienert T., Buehlmann D., Coletta L., Gallino D., Gass N., Garin C. M. , Nadkarni N. A. , Hübner N., Karatas M., Komaki Y., Kreitz S., Mandino F., Mechling A. E., Sato C., Sauer K., Shah D., Strobelt S., Takata N., Wank I., Wu T., Yahata N., Yun Yeow L., Yee Y., Aoki I. , Chakravarty M. M., Chang W-T., Dhenain M., Von Elverfeldt D., Harsan L. A., Hess A., Jiang T., Keliris G. A., Lerch J. P., Okano H., Rudin M., Sartorius A., Van der Linden A, Verhoye M., Weber-Fahr W., Wenderoth N., Zerbi V., Gozzi A.
NeuroImage. 2020. 205, Article 116278. https://doi.org/10.1016/j.neuroimage.2019.116278
Estimation of COVID-19 cases in France and in different countries: Homogeneisation based on mortality.
Dhenain Marc.
MedRxiv. https://doi.org/10.1101/2020.04.07.20055913
2019
Encephalopathy induced by Alzheimer brain inoculation in a non-human primate.
Gary C., Lam S.*, Herard A.S.*, Koch J.E., Petit F., Gipchtein P., Sawiak S.J., Caillierez R., Eddarkaoui S., Colin M., Aujard F., Deslys J.P., French Neuropathology Network, Brouillet E., Buée L., Comoy E.E., Pifferi F.*, Picq J-L*, Dhenain M.,
Acta Neuropathologica Communications. 2019. 7: 126. https://doi.org/10.1186/s40478-019-0771-x
Promoting healthspan and lifespan with caloric restriction in primates.
Pifferi F., Terrien J., Perret M., Epelbaum J., Blanc S., Picq J.L.*, Dhenain M.*, Aujard F.
Communication Biology, Nature Publishing Group. 2019. 2, 107. 7 https://doi.org/10.1038/s42003-019-0348-z
A 3D population-based brain atlas of the mouse lemur primate with examples of applications in aging studies and comparative anatomy.
Nadkarni N. A, Bougacha S., Garin C., Dhenain M., Picq J.-L.
NeuroImage. 2019. 185. 85-95. https://doi.org/10.1016/j.neuroimage.2018.10.010
Tridimensional mapping of Phox2b expressing neurons in the brainstem of adult Macaca fascicularis and identification of the retrotrapezoid nucleus.
Levy J., Facchinetti P., Jan C., Achour M., Bouvier C., Brunet J.F., Delzescaux T., Giuliano F.
Journal of Comparative Neurology. 2019. May 9. 1-10. https://doi.org/10.1002/cne.24713
Automated individualization of size-varying neurons in 2D microscopic images of macaque brain
You Z, Balbastre Y, Bouvier C., Souedet N., Gipchtein P, Hantraye P, Jan C, Herard A-S, Delzescaux T.
Front Neuroanat. 2019 Dec 17;13:98. https://doi.org/10.3389/fnana.2019.00098
Clément Garin (2015-2019): "Characterization of mouse lemur brain by anatomical, functional and glutamate MRI". PhD Thesis.
autres
Voxel-based statistical analysis of 3D immunostained tissue imaging.
Vandenberghe, M.E., Souedet, N., Herard, A.S., Ayral, A.M., Letronne, F., Balbastre, Y., Sadouni, E., Hantraye, P., Dhenain, M., Frouin, F., Lambert, J.C., Delzescaux, T.
Frontiers in Neuroscience. 2018; 12(article number 754). https://doi.org/10.3389/fnins.2018.00754
A combination of atlas-based and voxel-wise approaches to analyze metabolic changes in autoradiographic data from
Alzheimer's mice.
Lebenberg, J., Herard, A.S., Dubois, A., Dhenain, M., Hantraye, P., Delzescaux, T.
Neuroimage. 2011. 57(4): 1447-1457. https://doi.org/10.1016/j.neuroimage.2011.04.059