Exploration des effets des radiations ionisantes sur les cellules souches des kératinocytes.
Alors qu'il est bien établi que les radiations ionisantes peuvent induire des cancers de la peau, principalement des carcinomes, le rôle des cellules souches des kératinocytes dans le processus de carcinogenèse reste mal connu. De plus, la question de l'induction de cancer par des faibles doses de radiation est une question ouverte, comme celle de la susceptibilité individuelle au développement des tumeurs.
a. Comprendre la radiorésistance des CSK Nos travaux ont permis de montrer que les cellules souches des kératinocytes humains sont plus radio-résistantes que les kératinocytes plus différenciés de la couche basale. En particulier, elles réparent mieux les dommages à l'ADN, grâce notamment à la voie de signalisation contrôlée par le facteur de croissance FGF2. Nous cherchons à comprendre par quels mécanismes s'établit cette radiorésistance. De plus, nous étudions les conséquences à long terme de cette radiorésistance, qui peut favoriser la cancérisation cutanée par le maintien dans la peau de cellules souches ayant conservé des dommages cellulaires suite à l'irradiation. Pour cela nous nous intéressons à l'instabilité génétique et épigénétique dans des modèles en culture ou après reconstruction cutanée. | 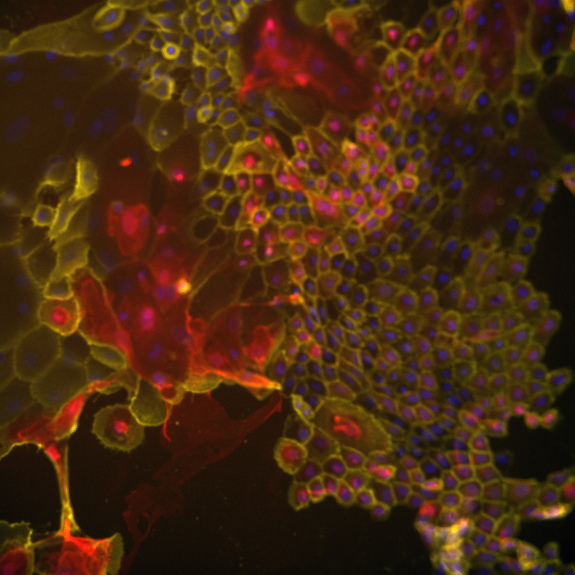
|
b. Prédisposition aux cancers radio induits
Plusieurs gènes ont été décrits comme des cibles de la formation des carcinomes cutanés, notamment les protéines p53 et Patched1. Nous nous intéressons à Patched1, car des mutations dans ce gène provoquent le syndrome de Gorlin, caractérisé par une radiosensibilité immédiate et une forte prédisposition au carcinome cutané. Nous recherchons dans la voie contrôlée par Patched1, qui est le récepteur membranaire de Sonic Hedgehog (SHH), quelles sont les protéines impliquées dans ces deux types de réponse au stress génotoxique. Nous utilisons comme modèle cellulaire des fibroblastes et des kératinocytes issus de patients atteints du syndrome de Gorlin ainsi que des holoclones modifiés pour porter des anomalies spécifiques des certains acteurs clés de la voie SHH.
Nous appliquerons cette approche dans une étude qui vise à mieux définir la radiosensibilité individuelle dans une cohorte de volontaires sains.