Au cœur de la médecine nucléaire
Le SHFJ est un lieu original : il est à la fois le service de médecine nucléaire du groupe hospitalier Nord-Essonne, totalisant plus de 3 500 examens par an, TEP et scintigraphies confondues, et un centre de R&D [1]. Ici, la recherche se conçoit au contact quotidien des médecins et au service des patients depuis sa création en 1958.
« La médecine nucléaire française s’est construite au SHFJ, relate Vincent Lebon, directeur de BioMaps. C’est ici, dans les années 1960 et 1970, que les premières techniques françaises d’imagerie fonctionnelle ont été développées et mises au point. D’abord la scintigraphie, avec l’iode et le technétium, puis la TEP avec l’utilisation de radiopharmaceutiques émetteurs de positons. La diffusion vers la médecine et l’hôpital a été massive, et nous l’avons accompagnée ».
C’est également en ces lieux que la totalité de la production francilienne de 18FDG, un analogue du glucose marqué au fluor-18 qui a révolutionné le diagnostic des cancers par la TEP, a été réalisée, de 1998 à 2008, laissant aux industriels le temps d’investir dans des cyclotrons et de prendre le relais. « Ce fut notre seule exception industrielle, sourit Vincent Lebon, car notre cœur de métier, c’est bien la R&D. Ici, nous inventons des radiopharmaceutiques innovants pour l’imagerie diagnostique et plus récemment, pour la thérapie. Nous travaillons sur toute la chaîne, depuis leur mise au point jusqu’au transfert industriel, en passant par la recherche préclinique et les essais cliniques que nous alimentons. C’est une infrastructure unique en France ».

Cyclotron du SHFH qui permet de produire des radiotraceurs pour la médecine nucléaire © P. Stroppa/CEA
Qu'est-ce que la médecine nucléaire ?C’est une spécialité médicale utilisant
la radioactivité à des fins diagnostiques (par l’imagerie, notamment la scintigraphie et la tomographie par émission de positons, dite TEP) ou thérapeutiques (par exemple contre les cancers), voire théranostiques (couplant les deux aspects), via des produits radiopharmaceutiques injectés au patient.
Qu’est-ce qu’un radiopharmaceutique ?
C’est une biomolécule sur laquelle un élément radioactif (un radioisotope, aussi appelé radionucléide) à vie courte a été greffé. Elle est choisie pour sa capacité à se fixer sur une cible que l’on cherche à observer ou à traiter, comme un organe (par exemple le cerveau) ou un tissu particulier du corps humain. Parfois, le radioisotope seul fait office de radiopharmaceutique, comme l’iode 123, 131 ou encore le radium 223.
Un portfolio d’une quinzaine de radiopharmaceutiques
Telles de grosses bonbonnes, deux cyclotrons (ce sont des accélérateurs circulaires) produisent les radioisotopes demandés par les équipes, le plus souvent du fluor-18 et du carbone-11 pour l’imagerie TEP. « Même s’il nous arrive d’en acheter à l’extérieur, par exemple du zirconium-89 et du cuivre-64 pour l’imagerie, et du lutétium-177 pour la thérapie », confie Bertrand Kuhnast, directeur du SHFJ. Non loin de là se trouvent les enceintes blindées pour la radiochimie. C’est là que les opérateurs fabriquent les radiopharmaceutiques qui seront utilisés en études précliniques ou cliniques (chez l’humain) selon l’état d’avancement des projets. « Au total, nous disposons d’un portfolio d'une quinzaine de molécules marquées au fluor-18 ou au carbone-11, validées pour les essais cliniques en imagerie TEP, affirme l‘expert. Et nous travaillons à flux tendu. Le fluor-18, c’est 2 heures de demi-vie [2], et le carbone-11, 20 minutes ! » Autrement dit, le patient n’est jamais loin, dans une pièce attenante.
Pour les diagnostics de soins courants, les praticiens hospitaliers recourent à des molécules et protocoles déjà bien rodés, comme le 18FDG devenu la référence pour localiser les tumeurs, ou encore la 18F-fluorodopa (Dopa marquée au fluor-18) pour la maladie de Parkinson. Pour autant, les chercheurs imaginent et préparent des solutions plus rapides ou plus précises, grâce à de nouveaux radiopharmaceutiques qui iront cibler telle molécule ou tel récepteur particulier dans l’organisme. Ainsi en est-il du LBT-999, une molécule marquée au fluor-18 pressentie pour le diagnostic de la maladie de Parkinson, qui propose une voie alternative à celle apportée par la 18F-fluorodopa. « Nous en avons produit une centaine de doses, entre 2022 et 2024, dans le cadre d’un essai clinique de phase III mené par Zionexa (GE HealthCare), avec la perspective de déposer une autorisation de mise sur le marché », chiffre Bertrand Kuhnast. Avantage par rapport à son autre concurrent le Datscan (marqué à l’iode-123) : un examen plus rapide, et donc plus confortable pour le patient. « Et, précise-t-il, nous sommes copropriétaires du brevet ».

Laboratoire de radiochimie du SHFJ, avec ses enceintes blindées. © L. Godart/CEA
Aller vers la radiothérapie interne vectorisée
L’autre voie de recherche est celle de la « radiothérapie interne vectorisée », en plein essor depuis 10 à 15 ans. Le CEA est certes moins identifié dans ce domaine que sur l’imagerie, mais l’activité monte en puissance, à la fois au SHFJ et du côté du futur réacteur Jules Horowitz, qui envisage de produire pour la communauté européenne des radioisotopes pour cet usage.
Jusque-là, les thérapies s’appuyaient essentiellement sur des radioisotopes seuls, tels l’iode-131 ou le radium-223 qui se fixent respectivement sur la thyroïde ou les os. Désormais, et de plus en plus, ces radioisotopes sont greffés sur une molécule « de guidage » afin d’atteindre une cible précise au niveau de la tumeur, pour y délivrer la radioactivité sans abîmer les tissus environnants. Aujourd’hui, seuls deux médicaments sont sur le marché, utilisant le lutétium-177 pour les tumeurs neuroendocrines et de la prostate. De nombreux essais cliniques sont en cours dans le monde, testant d’autres isotopes, comme l’actinium-225 ou le plomb-212. « Au SHFJ, nous travaillons essentiellement sur des anticorps [3] marqués au lutétium-177, et nous envisageons d’utiliser l’actinium-225 », indique Bertrand Kuhnast.
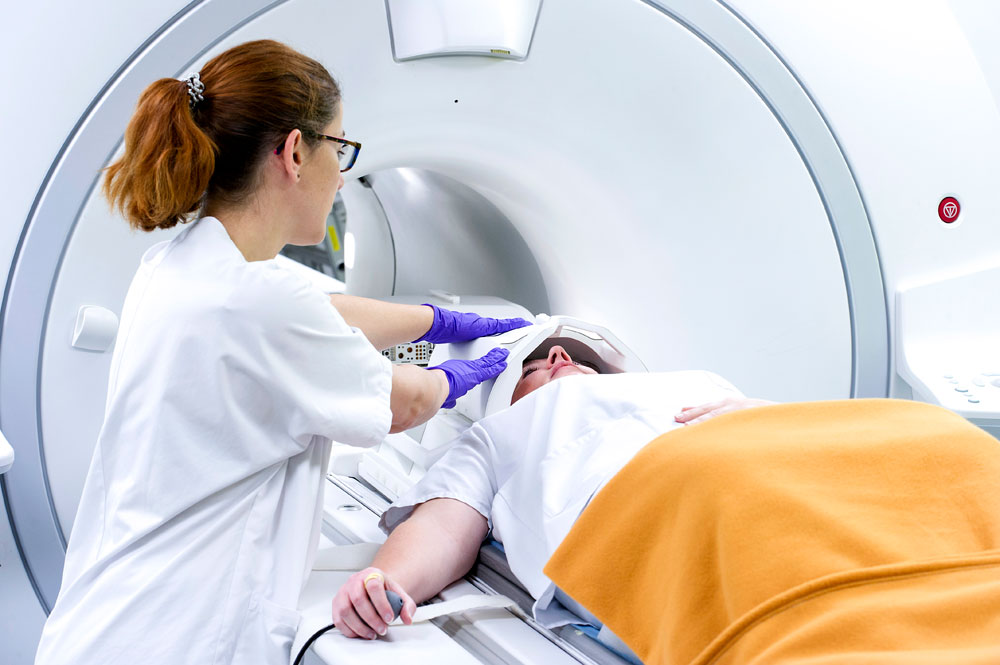
Réalisation d'un examen d'imagerie TEP/IRM au Service hospitalier Frédéric Joliot. © L. Godart/CEA
En parallèle à cette recherche thérapeutique, il existe un autre usage des radiopharmaceutiques, celui de la compréhension des mécanismes biologiques. « Il s’agit alors de comprendre la pathologie », explique Bertrand Kuhnast.
Démarche que le DPA-714 illustre parfaitement. Ce nom de code désigne une molécule marquée au fluor-18 fabriquée par le SHFJ pour étudier le rôle, encore très mal connu, de l’inflammation du tissu cérébral dans un grand nombre de pathologies neurologiques et neurodégénératives (Alzheimer, Parkinson, épilepsie, sclérose en plaques, etc.). « Avec nos partenaires, nous avons construit toute la chaîne de valeur du DPA-714, détaille-t-il, de l’élaboration du radiopharmaceutique à sa production, jusqu’à sa livraison à la dizaine d’hôpitaux partenaires des essais cliniques, en passant par sa validation en essais précliniques. Entre 600 et 800 doses ont été fabriquées ici ».
Au total, entre les études en recherche fondamentale pour la compréhension de pathologies et celles à visée diagnostique, le SHFJ est impliqué dans une quinzaine d’essais cliniques.
Et demain, Pasrel pour la médecine de précision
Après l’injection du radiopharmaceutique au patient, direction la caméra TEP pour l’acquisition de l’image de sa distribution dans l’organisme, en lien avec le fonctionnement des organes. Expert en imagerie, le SHFJ s’appuie pour ses recherches sur un parc ultra-moderne : TEP, mais aussi IRM, scanner à rayons X et échographique (ultrasons)[4]. « Notre but est de constamment améliorer la sensibilité de la détection de la radioactivité pour limiter les doses injectées aux patients, tout en garantissant des images optimales », affirme Bertrand Kuhnast.
A cette fin, deux pistes de R&D sont privilégiées. D’une part, le développement de nouveaux capteurs pour les photons émis par les émetteurs de positons, en jouant à la fois sur les matériaux et sur l’intégration d’IA. D’autre part, une recherche avale sur le développement des algorithmes pour l'interprétation et la quantification des images, là aussi grâce à l’IA. Avec à terme et dans l’idéal, des transferts industriels vers les grands noms du secteur, comme Philips, GE HealthCare ou Siemens Healthineers.
Enfin, la grande tendance, c’est le couplage de plusieurs modalités d’imagerie, pour obtenir des avantages diagnostiques supplémentaires et de meilleurs pronostics sur les réponses aux traitements. Si la TEP-scanner X est aujourd’hui le standard dans les hôpitaux, la TEP-IRM et la TEP-ultrasons sont encore en phase de recherche et ici explorées.
Pour l’avenir, les équipes s’apprêtent à migrer à quelques kilomètres de là, sur le plateau de Saclay, pour s’adosser au tout nouvel hôpital Paris-Saclay, ouvert depuis la mi-2024. Un changement d’échelle programmé vers 2029 et porté par le projet Pasrel, que pilote Vincent Lebon : « l’idée sous-jacente est d'inclure davantage les industriels, en synergie avec la recherche et l’hôpital, pour que les innovations thérapeutiques sur l'imagerie et la radiothérapie interne vectorisée puissent être déployées plus rapidement auprès du patient. Pasrel, c'est un SHFJ enrichi pour répondre aux attentes sociétales dans le domaine de la médecine de précision. »
Et d’ici quelques années, le RJH, réacteur Jules Horowitz
Le RJH sera un réacteur de recherche. Actuellement en phase finale de construction sur le site CEA de Cadarache, il sera opérationnel au milieu de la prochaine décennie. Son objectif premier est le soutien à la filière électronucléaire sur les réacteurs actuels et futurs. Une autre partie de son activité consistera à produire des radioisotopes pour la médecine. La sécurité d’approvisionnement de ces radioisotopes répond à en effet un enjeu de souveraineté nationale et européenne. Le RJH pourra produire entre 25 et 50 % des besoins annuels européens en radioisotopes pour les scintigraphies, soit l’équivalent de 15 000 examens par jour. Son haut flux neutronique et ses équipements lui permettront également de produire d’autres radioisotopes (lutétium-177, yttrium-90, etc.) qui viendront alimenter les essais cliniques, en particulier ceux explorant les traitements par radiothérapie interne vectorisée.
[1] La R&D au SHFJ est conduite par les chercheurs de l’unité mixte de recherche BioMaps, dont les tutelles sont le CEA, l’université Paris-Saclay, le CNRS et l'Inserm.
[2] Demi-vie : temps mis par une substance radioactive pour perdre la moitié de sa radioactivité.
[3] La spécificité des anticorps réside dans leur capacité à atteindre une ou plusieurs cibles avec une très grande précision, ce qui les classe parmi les outils les plus puissants de la médecine moderne.
[4] Seule la TEP fait partie des moyens d’imagerie dite nucléaire.