De la biologie structurale au développement d'anticancéreux
Depuis 20 ans environ, l’équipe Assemblages moléculaires et intégrité des génomes (CEA-Joliot/I2BC) étudie la protéine ASF1. Ce « chaperon d’histone », d’abord identifié comme impliqué dans la réponse cellulaire aux rayonnements ionisants, joue un rôle clef dans le maintien des informations épigénétiques au cours de la division cellulaire. Il est surexprimé dans plusieurs lignées cellulaires cancéreuses et sa raréfaction compromet sévèrement la prolifération cellulaire, faisant de la protéine une cible potentielle de traitements anticancéreux. Depuis leurs premiers travaux sur la structure de la protéine et son mode d’interaction dynamique avec le dimère d’histones H3-H4, l’équipe du CEA tente désormais d’ouvrir une nouvelle voie thérapeutique pour certains cancers, en particulier les cancers du sein très agressifs. Leur stratégie repose sur la conception de peptides qui vont s’associer à ASF1, en lieu et place des histones, de manière suffisamment sélective et spécifique pour empêcher ASF1 d’intervenir dans ses fonctions cellulaires pathologiques.
Dans une étude pilote basée sur une stratégie rationnelle mêlant approches structurales, informatiques et biochimiques, l’équipe avait créé un peptide inhibiteur (ip4) de l’interaction ASF1 – dimère H3-H4 ayant une affinité pour ASF1 de l’ordre du nM (Cf. actualité de 2019). Dans cette étude, les chercheurs ont montré
in vivo qu’ip4 a un effet inhibiteur potentiel sur la croissance tumorale. Ces travaux ont permis de valider la pertinence du ciblage d’ASF1 et de la stratégie de conception d’inhibiteurs d’ASF1.
Mimer les repliements moléculaires naturels avec des oligomères synthétiques
Les premiers peptides, dont ip4, étant trop sensibles à la protéolyse pour être utilisés tels quels en thérapie, les chercheurs sont allés un cran plus loin en tentant de synthétiser de nouveaux peptides de structure très proche des premiers, à partir de briques de synthèse les rendant plus résistant à la protéolyse. Des études ont montré que des polymères artificiels, les foldamères, pouvaient reproduire des structures bien définies de molécules du vivant (protéines, acides nucléiques…) et notamment qu’ils pouvaient être utilisés pour remplacer une partie d’un peptide thérapeutique sans modifier son activité. Dans une nouvelle étude publiée dans Science Advances, l’équipe s’est associée à des chimistes de l’Institut Européen de Chimie et Biologie (CNRS/Université Bordeaux ; équipe de Gilles Guichard) pour concevoir des foldamères inhibiteurs d’ASF1. Une partie de la chaine polypeptidique des peptides inhibiteurs étant enroulée sur elle-même de façon régulière (on parle de structure en hélice alpha), le choix des chimistes s’est porté sur l’utilisation d’oligo-urées, connus pour mimer les hélices alpha. C’est ainsi que les chercheurs ont conçu une molécule hybride foldamère/peptide, inhibiteur d’ASF1. La résistance à la protéolyse dans le plasma humain est bien supérieure à celle du peptide α-hélicoïdal apparenté. L’insertion de 4 briques de type urée au centre de l’hélice est suffisante pour protéger le peptide chimérique de la protéolyse. La structure cristalline du complexe peptide chimérique/ASF1 révèle une plasticité remarquable du squelette « urée » qui s’adapte à la surface d’ASF1 et maintient la même interface de liaison qu’un peptide inhibiteur non chimérique. L’affinité pour ASF1 et la biodisponibilité de ces nouveaux composés doivent encore être optimisés pour une inhibition efficace d’ASF1 dans les cellules.
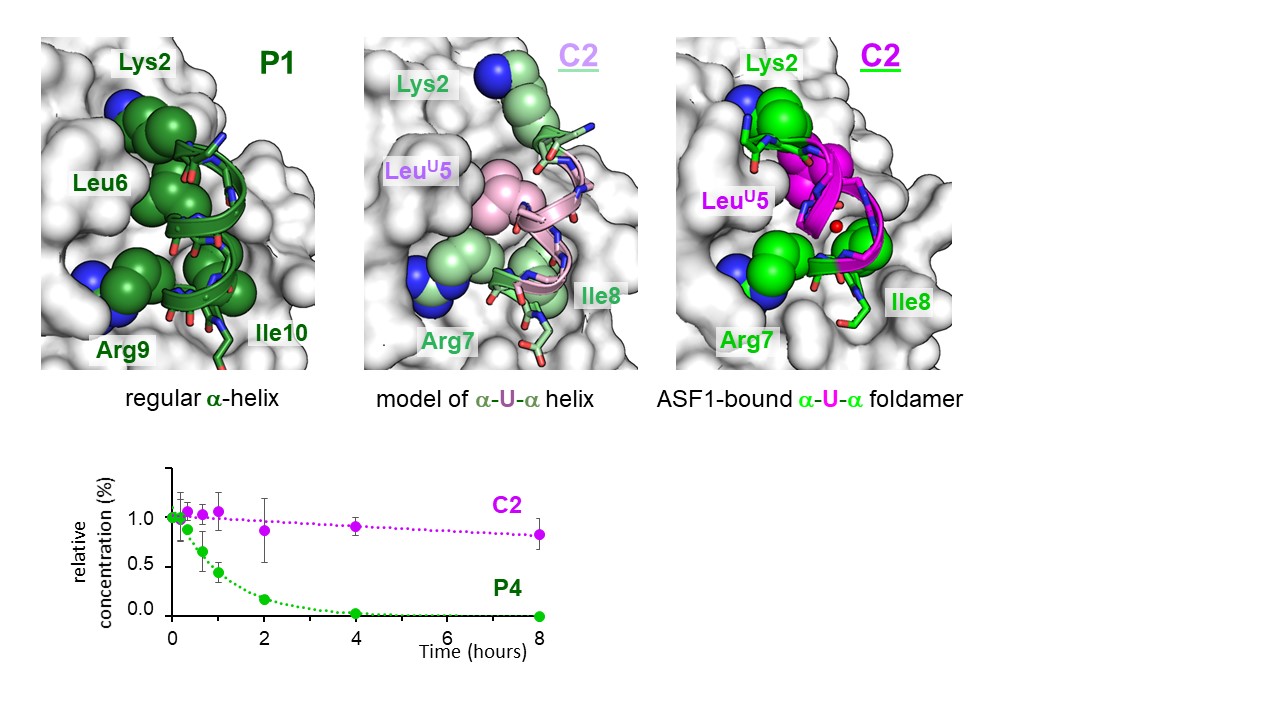
Panneau du haut : comparaison de la structure du peptide chimérique (C2) seul (milieu) ou en interaction avec ASF1 (droite) avec celle du peptide P1 lié à ASF1 (gauche). P1 correspond à la partie hélicoïdale du peptide ip4 trouvé dans la précédente étude.
Panneau du bas : Détermination par LC/MS de la résistance à la protéolyse du peptide chimérique C2 et du peptide P4 qui correspond à une partie hélicoïdale du peptide ip4 (plus petite que P1).
Contact chercheur :
Françoise Ochsenbein (francoise.ochsenbein@cea.fr)
[1] Détermination par chromatographie liquide couplée à
de la spectrométrie de masse au LEMM (SPI/DMTS, institut Joliot)