Cette étude a mobilisé des chercheurs de l'Institut de Biosciences et Biotechnologies d'Aix-Marseille à Cadarache, de l'Institut de Biologie Intégrative de la Cellule à Gif-sur-Yvette, de l'Institut Polytechnique de Paris à Palaiseau, de l'Institut de Biologie Structurale de Grenoble, des Universités de Lille et de Rennes, de l'Installation Européenne de Rayonnement Synchrotron et de l'Institut Laue Langevin (tous deux à Grenoble), l'Institut Max-Planck de Heidelberg, l'Université d'État de Moscou et le Laboratoire National d'Accélérateur SLAC aux États-Unis.
Les photoenzymes sont des biocatalyseurs très rares qui utilisent la lumière pour réaliser leur réaction chimique. La photodécarboxylase d'acide gras (Fatty Acid Photodecarboxylase, FAP), récemment découverte dans une microalgue, la chlorelle, fait partie des quelques photoenzymes naturelles identifiées jusqu'à présent. Elle permet la formation d'hydrocarbures à partir d'acides gras, un processus très prometteur pour la production de biocarburants et la chimie verte (voir Fait Marquant 2017). Cependant, la manière dont la réaction s'accomplit au sein même de l'enzyme était restée assez mystérieuse. L'observation du fonctionnement de la FAP au niveau moléculaire vient d'être réalisée par un consortium international de scientifiques (voir encadré). L'une des clés du succès a été la combinaison sans précédent d'approches expérimentales et théoriques comprenant la mutagenèse dirigée, la spectroscopie infrarouge à transformée de Fourier (FTIR), le piégeage à cryotempérature d'intermédiaires réactionnels, les cristallographies statique et cinétique réalisées à des synchrotrons et avec un laser à électrons libres à rayons X (XFEL), des spectroscopies vibrationnelles, statiques et résolues en temps, et des calculs de chimie quantique.
Le cycle catalytique de la FAP est initié par l'absorption d'un photon par la flavine (un dérivé de la vitamine B2 incorporé dans l'enzyme) et le transfert en 300 picosecondes d'un électron de l'acide gras substrat à la flavine photo-excitée. Le consortium a établi que ce transfert d'électron conduit quasi-instantanément à l'étape catalytique fondamentale : la dissociation du substrat en précurseur d'hydrocarbure et en dioxyde de carbone (CO2). Une grande surprise est la découverte que la majorité du CO2 généré est rapidement (en 100 nanosecondes) transformée en bicarbonate (HCO3-) au sein de l'enzyme, et que cela implique une molécule d'eau et un acide aminé particuliers. Une autre découverte inattendue est la conformation pliée inhabituelle de la molécule de flavine dont le spectre d'absorption est déplacé vers le rouge, de sorte qu'elle récolte des photons non exploités pour l'activité photosynthétique de la microalgue. L'interprétation combinée des résultats des diverses approches expérimentales et théoriques donne maintenant une image détaillée, à l'échelle atomique, de la FAP à l'œuvre (Figure).
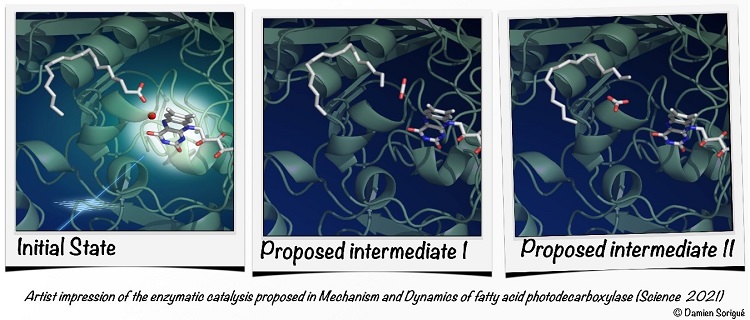 Artist impression of the enzymatic catalysis proposed in mechanism and dynamics of fatty-acid photodecarboxylase (Science, 2021) © D Sorigué/CEA
Artist impression of the enzymatic catalysis proposed in mechanism and dynamics of fatty-acid photodecarboxylase (Science, 2021) © D Sorigué/CEA
La photoenzyme FAP représente aussi une nouvelle opportunité pour la production durable de biocarburants à base d'hydrocarbures non fossiles : en utilisant la lumière, les acides gras produits par les microorganismes peuvent être transformés par la FAP, en une seule étape, en hydrocarbures qui sont facilement utilisables comme carburant. La FAP est également très prometteuse pour la décarboxylation par la lumière d'acides carboxyliques fonctionnalisés pour former des produits à plus haute valeur ajoutée. L'élucidation du mécanisme catalytique de la FAP constitue donc une base solide pour l'optimisation de l'enzyme en vue de la production d'hydrocarbures et d'autres molécules par des méthodes plus "vertes".
Contacts: pour le BIAM: Frédéric Beisson (frederic.beisson@cea.fr); pour l'I2BC: Pavel Müller (pavel.muller@i2bc.paris-saclay.fr); pour le LOB: Marten Vos (marten.vos@polytechnique.edu); pour l'IBS: Martin Weik (weik@ibs.fr ).
Lien vers le Communiqué de Presse du CEA (8 avril 2021)