Les photolyases de l'ADN constituent avec les cryptochromes une famille d'enzymes photoactives largement répandues dans tous les règnes du vivant. Les photolyases* réparent les lésions induites dans l'ADN par les UV, tandis que les cryptochromes interviennent dans des processus de régulation.
Ces derniers sont des photorécepteurs de lumière bleue chez les plantes et les animaux, ayant une forte homologie de séquence et de structure avec les photolyases, mais sans activité de réparation de l'ADN. Les réponses cryptochromes-dépendantes peuvent être affectées par un champ magnétique faible, et un tel effet pourrait être à la base de la boussole magnétique des oiseaux.
Photolyases et cryptochromes sont des flavoprotéines qui utilisent le FAD comme cofacteur. Un élément fonctionnel commun des photolyases et des cryptochromes est une chaine de transfert d'électrons composée typiquement de trois résidus tryptophane qui permet de réduire le cofacteur FAD excité par un photon. Cette réaction dénommée "photoactivation" est préalable à la photoréparation de l'ADN par les photolyases et, chez les cryptochromes, elle active la signalisation.
En comparant des séquences d'acides aminés de différents membres de la superfamille des Cryptochromes - Photolyases publiées, nous avons remarqué qu'une sous-famille composée des cryptochromes d'animaux et des photolyases dites "6-4" (spécialisées dans la réparation d'une lésion particulière de l'ADN, le photoproduit pyrimidine(6-4)pyrimidone) possède un tryptophane supplémentaire en une position qui suggère son implication comme quatrième membre de la chaine de transfert d'électron (Fig. 1).
Nous avons étudié par spectroscopie d'absorption cinétique le rôle fonctionnel de ce quatrième tryptophane dans la photolyase (6-4) de Xenopus laevis (Xl(6-4)PL) qui a été surexprimée dans le laboratoire du Dr Junpei Yamomoto (Osaka, Japon). En comparant la protéine sauvage avec une protéine mutée (dont le quatrième tryptophane W370 est remplacé par une phénylalanine (F) qui ne peut pas transférer un électron), nous avons pu établir que le quatrième tryptophane sert à stabiliser la photoactivation: le temps de vie de la paire de radicaux FAD°− Trp° dans la protéine sauvage est de 40 ms contre 10 µs dans la protéine mutée W370F (Fig. 2).
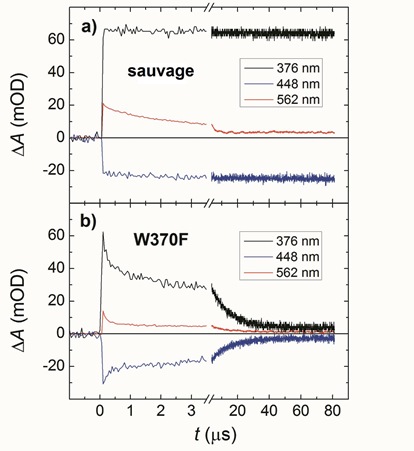 | Figure 2 : Cinétiques de changement d'absorption reflétant l'évolution des radicaux FAD°− TrpH°+ et FAD°− Trp° induits par la photoexcitation du FAD dans Xl(6-4)PL sauvage et dans Xl(6-4)PL avec une mutation du quatrième tryptophane (W370F). Sur l'échelle de temps montrée, la paire primaire dans la protéine sauvage (FAD°− Trp4H°+) ne subit que la déprotonation du Trp4H°+ (avec une constante de temps de 2.5 microsecondes, visible à 562 nm) mais la paire résultante (FAD°− Trp4°) reste stable. Dans la protéine mutée, au contraire, le Trp3H°+ déprotone (6 à 7 fois) plus rapidement et la paire résultante (FAD°− Trp3°) recombine presque complètement en quelques dizaines de microsecondes. |
Etant donnée la conservation du quatrième tryptophane au sein des cryptochromes animaux, il se pose la question d'un rôle de celui-ci dans la magnéto réception, les réactions impliquant des paires de radicaux étant en effet de bons candidats pour expliquer de tels phénomènes. Bien que l'interaction plus faible des partenaires plus éloignés d'une paire de radicaux devrait être favorable à un effet d'un champ magnétique aussi faible que le champ terrestre sur les réactions de la paire, l'absence d'une recombinaison des charges dans la paire en compétition avec la relaxation de spin (typiquement <100 µs) semble exclure la paire FAD°− Trp° dans le cryptochrome comme candidat pour la boussole des animaux.
Des expériences complémentaires de spectroscopie femtoseconde (collaboration avec le Dr Pascal Plaza à l'ENS Paris) et simulation dynamique moléculaire et mécanique quantique (collaboration avec les Drs Aurélien de la Lande et Fabien Calliez à l'Université Paris Sud) sont en cours pour affiner ces résultats.
* L'importance de la recherche sur la réparation de l'ADN par les photolyases a été soulignée par le Prix Nobel de Chimie 2015.